题目内容
铁元素在人类生活中扮演着非常重要的角色,不仅仅是重要的建筑材料,也是人体必须的微量元素.每年钢铁的腐蚀带来巨大的经济损失.某校研究小组在实验室中模拟钢铁在自然环境下的腐蚀,设置如图1装置,几天后观察结果:
请回答下列问题:
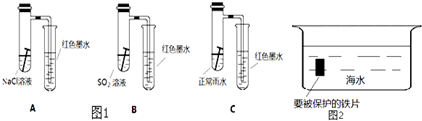
(1)请比较以上三个装置中右侧导管中红墨水的高度: > > 请写出A装置中,钢铁锈蚀时正极反应的电极反应式
(2)钢铁的防腐有重大的意义,生活中常将金属制品放在干燥处或者涂上矿物油予以保护,现请你从电化学角度设计一种方法保护图中钢铁以免被腐蚀,请将图2完成:
请回答下列问题:
(1)请比较以上三个装置中右侧导管中红墨水的高度:
(2)钢铁的防腐有重大的意义,生活中常将金属制品放在干燥处或者涂上矿物油予以保护,现请你从电化学角度设计一种方法保护图中钢铁以免被腐蚀,请将图2完成:

考点:金属的电化学腐蚀与防护
专题:
分析:(1)强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,A装置溶液呈中性,铁发生吸氧腐蚀,正极上氧气得电子发生还原反应;
(2)作原电池正极或电解池阴极的金属被保护.
(2)作原电池正极或电解池阴极的金属被保护.
解答:
解:(1)强酸性条件下,铁发生析氢腐蚀,中性或弱酸性条件下,铁发生吸氧腐蚀,A装置溶液呈中性,铁发生吸氧腐蚀,B、C溶液呈酸性,铁发生析氢腐蚀,但B中酸性较强,所以铁发生腐蚀严重,发生吸氧腐蚀时左边试管中压强减小,右边导管中红墨水上升,B、C右边导管中红墨水下降,且B下降比C多,所以右侧导管中红墨水高度:A>C>B;
A中铁发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,
故答案为:A>C>B;O2+4e-+2H2O=4OH-;
(2)作原电池正极或电解池阴极的金属被保护,所以Fe可以连接比铁活泼的金属或连接电源负极,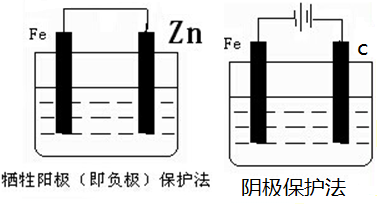 故答案为:
故答案为: .
.
A中铁发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,
故答案为:A>C>B;O2+4e-+2H2O=4OH-;
(2)作原电池正极或电解池阴极的金属被保护,所以Fe可以连接比铁活泼的金属或连接电源负极,
 故答案为:
故答案为: .
.
点评:本题考查金属腐蚀与防护,明确原电池原理和电解池原理即可解答,知道钢铁发生析氢腐蚀和吸氧腐蚀的条件、区别,知道防止金属被腐蚀的方法,题目难度不大.

练习册系列答案
相关题目
下列实验操作正确的是( )
A、 制氨气 |
B、 收集CO2或NO |
C、 配制稀硫酸 |
D、 氨气的吸收 |
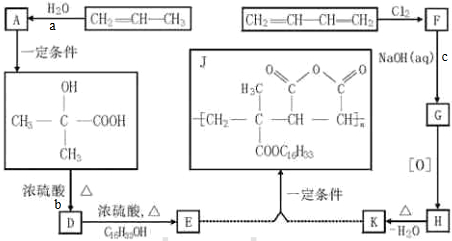

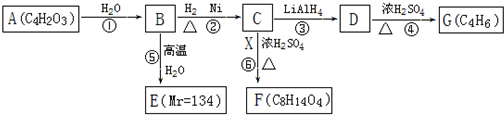
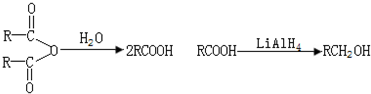
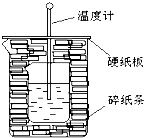 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: