题目内容
A、B、C、D、E为原子序数依次增大的五种短周期元素,其性质或结构信息如表:
试回答以下问题:
(1)B在周期表中的位置是 ,B的氢化物与E的氢化物比较,沸点较高的是(填化学式).
(2)写出DaB与甲反应所得溶液呈 (填“酸性”、“碱性”或“中性”),原因是(用离子方程式表示) .
(3)写出丙的电子式为 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示) .
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性.
I.可用来鉴别丁和氯化钠的试剂有 .
A.氢碘酸和淀粉的混合液 B.A斟03溶液 C.稀硫酸
Ⅱ.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深蓝色溶液,写出该反应的离子方程式 .
Ⅲ.泡菜含有多种维生素和无机盐,但也含有丁.一般情况下,当人体一次性摄取300~500mg丁时,就会引起中毒.某学习小组用碘量法测定泡菜中丁的含量.已知:
2Na2S2O3+I2═Na2S4O6+2NaI.取1kg泡菜榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的有毒无机盐都转化为丁.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至1L,取25.00mL该滤液与过量的稀硫酸和碘化钾的混合溶液反应,再选用合适的指示剂,用Na2S2O3溶液进行滴定,共消耗0.050mol?L-1 Na2S2O3溶液20.00mL.请回答下列问题:
①有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻丁的危害.主要是因为橙汁中含有丰富的维生素C,这说明维生素C具有 性.
②通过计算判断某人一次食入0.125kg这种泡菜是否会引起中毒,原因是 .
| 元素 | A | B | C | D | |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同. | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强 |
(1)B在周期表中的位置是
(2)写出DaB与甲反应所得溶液呈
(3)写出丙的电子式为
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性.
I.可用来鉴别丁和氯化钠的试剂有
A.氢碘酸和淀粉的混合液 B.A斟03溶液 C.稀硫酸
Ⅱ.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深蓝色溶液,写出该反应的离子方程式
Ⅲ.泡菜含有多种维生素和无机盐,但也含有丁.一般情况下,当人体一次性摄取300~500mg丁时,就会引起中毒.某学习小组用碘量法测定泡菜中丁的含量.已知:
2Na2S2O3+I2═Na2S4O6+2NaI.取1kg泡菜榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的有毒无机盐都转化为丁.在过滤后的滤液中加入氢氧化铝乳液,以除去色素.再次过滤后得到滤液,将该滤液稀释至1L,取25.00mL该滤液与过量的稀硫酸和碘化钾的混合溶液反应,再选用合适的指示剂,用Na2S2O3溶液进行滴定,共消耗0.050mol?L-1 Na2S2O3溶液20.00mL.请回答下列问题:
①有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻丁的危害.主要是因为橙汁中含有丰富的维生素C,这说明维生素C具有
②通过计算判断某人一次食入0.125kg这种泡菜是否会引起中毒,原因是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D为原子序数依次增大的四种短周期元素,
D单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体,则D是Na元素;
A室温下单质呈气态,原子最外层电子数与D相同,则A是H元素;
D3B中阳离子与阴离子的电子层结构相同,B显-3价,且阴阳离子电子层结构相同,所以B是N元素;
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性,C的原子序数大于B小于C,所以C是O元素,乙是双氧水;
E是一种气态氧化物丙,丙相对于空气的密度为3.0,则丙的相对分子质量是87,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强,则丙是Cl2O.
D单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体,则D是Na元素;
A室温下单质呈气态,原子最外层电子数与D相同,则A是H元素;
D3B中阳离子与阴离子的电子层结构相同,B显-3价,且阴阳离子电子层结构相同,所以B是N元素;
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性,C的原子序数大于B小于C,所以C是O元素,乙是双氧水;
E是一种气态氧化物丙,丙相对于空气的密度为3.0,则丙的相对分子质量是87,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强,则丙是Cl2O.
解答:
解:A、B、C、D为原子序数依次增大的四种短周期元素,
D单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体,则D是Na元素;
A室温下单质呈气态,原子最外层电子数与D相同,则A是H元素;
D3B中阳离子与阴离子的电子层结构相同,B显-3价,且阴阳离子电子层结构相同,所以B是N元素;
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性,C的原子序数大于B小于C,所以C是O元素,乙是双氧水;
E是一种气态氧化物丙,丙相对于空气的密度为3.0,则丙的相对分子质量是87,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强,则丙是Cl2O,
(1)B原子核外有两个电子层,最外层有5个电子,所以B位于第二周期第VA族,氨气的沸点比氯化氢高,氨气的溶解度比氯化氢大,
故答案为:第二周期ⅤA族;NH3;
(2)氮化钠和水反应生成氨气和氢氧化钠,所以溶液呈碱性,反应方程式为Na3N+3H2O=NH3↑+3NaOH,
故答案为:碱性;N3-+4H2O═NH3?H2O+3OH-;
(3)丙是Cl2O,其电子式为: ,次氯酸是弱酸,在光照条件下,次氯酸分解生成盐酸和氧气,所以溶液酸性增强,发生2HClO
,次氯酸是弱酸,在光照条件下,次氯酸分解生成盐酸和氧气,所以溶液酸性增强,发生2HClO
2HCl+O2↑,
故答案为: ;2HClO
;2HClO
2HCl+O2↑;
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性,则丁是亚硝酸钠,
A.亚硝酸钠能氧化氢碘酸生成碘单质,碘遇淀粉变蓝色,氯化钠和氢碘酸不反应,所以现象不同,可以鉴别,故A选;
B.氯化钠与硝酸银反应生成白色沉淀,亚硝酸钠和硝酸银不反应,所以可以鉴别,故B选;
C.氯化钠和稀硫酸不反应,亚硝酸钠和稀硫酸反应生成亚硝酸,亚硝酸不稳定生成一氧化氮、二氧化氮,所以现象不同,故C选;
故选ABC;
Ⅱ.酸性条件下,铜被亚硝酸钠氧化生成,同时亚硝酸钠被还原生成一氧化氮,反应方程式为Cu+2NO2 -+4H +=Cu 2++2NO↑+2H2O,
故答案为:Cu+2NO2-+4H+=Cu2++2NO↑+2H2O;
Ⅲ.①亚硝酸钠具有氧化性,能够将具有强还原性的维生素C氧化,故答案为:还原;
②根据反应,2NaNO2+2H2SO4+2KI=K2SO4+I2+2H2O+Na2SO4+2NO
I2+2Na2S2O3=2NaI+Na2S4O6,
可以得出关系式:2NaNO2~I2~2Na2S2O3,可以得出n(NaNO2)=n(Na2S2O3),
三次滴定消耗的标准液的体积分别为:20.04mL、19.96mL、20.00mL,平均体积为:
=20.00mL,
原1L溶液中含有的亚硫酸钠的物质的量是:
×0.05000mol?L-1×0.02L=0.04mol,
1Kg泡菜含有的亚硝酸钠的质量是:69g/mol×0.04mol=2.76g,
0.125Kg泡菜含有的亚硝酸钠质量是:
×2.76g=0.345g=345mg>300,会引起中毒,
故答案为:由于524.4mg>300,会引起中毒.
D单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体,则D是Na元素;
A室温下单质呈气态,原子最外层电子数与D相同,则A是H元素;
D3B中阳离子与阴离子的电子层结构相同,B显-3价,且阴阳离子电子层结构相同,所以B是N元素;
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性,C的原子序数大于B小于C,所以C是O元素,乙是双氧水;
E是一种气态氧化物丙,丙相对于空气的密度为3.0,则丙的相对分子质量是87,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强,则丙是Cl2O,
(1)B原子核外有两个电子层,最外层有5个电子,所以B位于第二周期第VA族,氨气的沸点比氯化氢高,氨气的溶解度比氯化氢大,
故答案为:第二周期ⅤA族;NH3;
(2)氮化钠和水反应生成氨气和氢氧化钠,所以溶液呈碱性,反应方程式为Na3N+3H2O=NH3↑+3NaOH,
故答案为:碱性;N3-+4H2O═NH3?H2O+3OH-;
(3)丙是Cl2O,其电子式为:
 ,次氯酸是弱酸,在光照条件下,次氯酸分解生成盐酸和氧气,所以溶液酸性增强,发生2HClO
,次氯酸是弱酸,在光照条件下,次氯酸分解生成盐酸和氧气,所以溶液酸性增强,发生2HClO
| ||
故答案为:
 ;2HClO
;2HClO
| ||
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性,则丁是亚硝酸钠,
A.亚硝酸钠能氧化氢碘酸生成碘单质,碘遇淀粉变蓝色,氯化钠和氢碘酸不反应,所以现象不同,可以鉴别,故A选;
B.氯化钠与硝酸银反应生成白色沉淀,亚硝酸钠和硝酸银不反应,所以可以鉴别,故B选;
C.氯化钠和稀硫酸不反应,亚硝酸钠和稀硫酸反应生成亚硝酸,亚硝酸不稳定生成一氧化氮、二氧化氮,所以现象不同,故C选;
故选ABC;
Ⅱ.酸性条件下,铜被亚硝酸钠氧化生成,同时亚硝酸钠被还原生成一氧化氮,反应方程式为Cu+2NO2 -+4H +=Cu 2++2NO↑+2H2O,
故答案为:Cu+2NO2-+4H+=Cu2++2NO↑+2H2O;
Ⅲ.①亚硝酸钠具有氧化性,能够将具有强还原性的维生素C氧化,故答案为:还原;
②根据反应,2NaNO2+2H2SO4+2KI=K2SO4+I2+2H2O+Na2SO4+2NO
I2+2Na2S2O3=2NaI+Na2S4O6,
可以得出关系式:2NaNO2~I2~2Na2S2O3,可以得出n(NaNO2)=n(Na2S2O3),
三次滴定消耗的标准液的体积分别为:20.04mL、19.96mL、20.00mL,平均体积为:
| 20.04mL+19.96mL+20.00mL |
| 3 |
原1L溶液中含有的亚硫酸钠的物质的量是:
| 1000ml |
| 25ml |
1Kg泡菜含有的亚硝酸钠的质量是:69g/mol×0.04mol=2.76g,
0.125Kg泡菜含有的亚硝酸钠质量是:
| 0.125Kg |
| 1Kg |
故答案为:由于524.4mg>300,会引起中毒.
点评:本题考查元素化合物性质,正确推断元素是解本题关键,利用物质的性质来分析解答即可,难度中等.

练习册系列答案
相关题目
旅游洞穴一般是指供游人观览的喀斯特洞穴,多姿多彩的钟乳石,石笋,石柱,石花等碳酸钙沉积体是喀斯特洞穴中的主要景观.由于游人呼吸有时会使旅游洞穴中二氧化碳浓度大幅度升高,可能造成的后果是( )
①抑制碳酸钙沉积体的生长
②促进碳酸钙沉积体的生长
③使游客有憋闷的感觉
④使照明灯下的植物大量死亡.
①抑制碳酸钙沉积体的生长
②促进碳酸钙沉积体的生长
③使游客有憋闷的感觉
④使照明灯下的植物大量死亡.
| A、①③ | B、②③ | C、①④ | D、②④ |
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、加入Al能放出H2的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| B、能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- |
| C、无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| D、常温下,在c(H+)/c(OH-)=1×10-12的溶液中:Fe2+、Cu2+、Cl-、NO3- |
下列离子检验的方法正确的是( )
| A、某待测液加入AgNO3溶液,生成白色沉淀,说明原溶液中有Cl- |
| B、某待测液加入BaCl2溶液,生成白色沉淀,说明原溶液中有SO42- |
| C、某待测液加入CaCl2溶液,生成白色沉淀,说明原溶液中有CO32- |
| D、某待测液加入NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ |
汽车燃油不完全燃烧时产生CO2有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H>0,小明学完“化学反应的方向”后,认为该反应不可能实现,最合理的解释是( )
| A、该反应是熵减小反应 |
| B、该反应是吸热反应 |
| C、该反应需要和高的温度 |
| D、该反应是熵减小,烙增加的反应 |
 某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.
某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.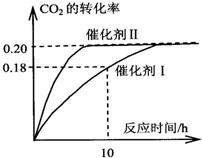 已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.3000C时的恒容密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题:
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.3000C时的恒容密闭容器中,当C(CO2)=1.00mol.L-1C(H2)=1.60mol.L-1开始反应,结果如图所示,回答下列问题: