题目内容
下列说法正确的是( )
①具有规则几何外形的固体一定是晶体
②含有阳离子的晶体一定是离子晶体
③非极性分子中一定含有非极性键
④s-s σ键与s-p σ键的电子云形状相同
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥因为H-F的键能大于H-Cl的键能,所以HF的沸点高于HCl
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体.
①具有规则几何外形的固体一定是晶体
②含有阳离子的晶体一定是离子晶体
③非极性分子中一定含有非极性键
④s-s σ键与s-p σ键的电子云形状相同
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥因为H-F的键能大于H-Cl的键能,所以HF的沸点高于HCl
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体.
| A、①②⑤⑥ | B、③⑦⑧ |
| C、⑦⑧ | D、③④⑤⑧ |
考点:不同晶体的结构微粒及微粒间作用力的区别,离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:①具有规则几何外形的固体不一定是晶体;
②金属晶体由阳离子和自由电子构成;
③结构对称、正负电荷中心重合的分子为非极性分子;
④s-s σ键与s-p σ键的电子云形状不同;
⑤含有共价键的晶体不一定具有高的熔、沸点及硬度,要根据晶体类型判断;
⑥HF分子间能形成氢键,根据氢键对物理性质的影响分析;
⑦π键和σ键的活泼性不同导致物质的化学性质不同;
⑧中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体.
②金属晶体由阳离子和自由电子构成;
③结构对称、正负电荷中心重合的分子为非极性分子;
④s-s σ键与s-p σ键的电子云形状不同;
⑤含有共价键的晶体不一定具有高的熔、沸点及硬度,要根据晶体类型判断;
⑥HF分子间能形成氢键,根据氢键对物理性质的影响分析;
⑦π键和σ键的活泼性不同导致物质的化学性质不同;
⑧中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体.
解答:
解:①晶体具有以下特点:有整齐规则的几何外形; 晶体有固定的熔点;有各向异性的特点,只有同时具备这三个条件的才是晶体,故错误;
②金属晶体由阳离子和自由电子构成,所以含有阳离子的晶体不一定是离子晶体,故错误;
③结构对称、正负电荷中心重合的分子为非极性分子,非极性分子中不一定含有非极性键,如O=C=O中不含非极性键,故错误;
④S能级电子云是球形,P能级电子云是哑铃型,所以s-s σ键与s-p σ键的电子云形状不同,故错误;
⑤含有共价键的晶体不一定具有高的熔、沸点及硬度,如分子晶体的熔、沸点及硬度较低,故错误;
⑥HF分子间能形成氢键,HCl分子间不能形成氢键,氢化物中含有氢键的熔沸点较高,HF的沸点高于HCl,与分子内的共价键无关,故错误;
⑦π键和σ键的活泼性不同导致物质的化学性质不同,含有π键的物质性质较活泼,故正确;
⑧中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,故正确;
所以正确的有⑦⑧;
故选C.
②金属晶体由阳离子和自由电子构成,所以含有阳离子的晶体不一定是离子晶体,故错误;
③结构对称、正负电荷中心重合的分子为非极性分子,非极性分子中不一定含有非极性键,如O=C=O中不含非极性键,故错误;
④S能级电子云是球形,P能级电子云是哑铃型,所以s-s σ键与s-p σ键的电子云形状不同,故错误;
⑤含有共价键的晶体不一定具有高的熔、沸点及硬度,如分子晶体的熔、沸点及硬度较低,故错误;
⑥HF分子间能形成氢键,HCl分子间不能形成氢键,氢化物中含有氢键的熔沸点较高,HF的沸点高于HCl,与分子内的共价键无关,故错误;
⑦π键和σ键的活泼性不同导致物质的化学性质不同,含有π键的物质性质较活泼,故正确;
⑧中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,故正确;
所以正确的有⑦⑧;
故选C.
点评:本题考查的知识点较综合,杂化类型的判断及分子构型的判断是学习的难点,氢键及分子晶体中原子的杂化类型是高考的热点,要重点掌握.

练习册系列答案
相关题目
在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
| A、NH4+、Al3+、SO42-、NO3- |
| B、K+、NH4+、MnO4-、SO42- |
| C、Na+、OH-、NO3-、HCO3- |
| D、K+、Cu2+、CH3COO-、NO3- |
下列说法不正确的是( )
| A、假说经过反复验证和修正,才发展成为科学的理论 |
| B、化学模型在研究物质的结构和性质变化时有很重要的作用 |
| C、研究物质的性质常用观察、实验、分类、比较等方法 |
| D、探究物质性质的基本程序是做实验并观察实验现象→分析、解释,得出结论 |
下列各组物质按酸碱盐分类顺序排列,正确的是( )
| A、硫酸、纯碱、硫酸钙 |
| B、氢硫酸、烧碱、胆矾 |
| C、碳酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钠 |
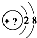 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.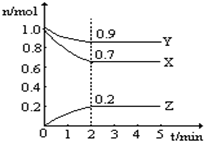 某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: