题目内容
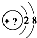 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.(1)该微粒的符号为X3-,则这种微粒的单质的电子式为
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式:
(3)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式:
(4)该微粒处于第三周期且其离子半径为该周期所有元素离子半径最小的一个,其最高价氧化物对应的水化物与强碱反应的离子方程式:
考点:原子结构示意图,原子结构与元素的性质
专题:原子组成与结构专题
分析:(1)阴离子:质子数=核外电子数-电荷数=10-3=7,故该元素为N;
(2)阴离子:质子数=核外电子数-电荷数=10-1=9,故该元素为F;
(3)阴离子:质子数=核外电子数-电荷数=10-2=8,故该元素为O;
(4)第三周期,离子半径最小的是铝离子,其最高价氧化物对应的水化物为氢氧化铝.
(2)阴离子:质子数=核外电子数-电荷数=10-1=9,故该元素为F;
(3)阴离子:质子数=核外电子数-电荷数=10-2=8,故该元素为O;
(4)第三周期,离子半径最小的是铝离子,其最高价氧化物对应的水化物为氢氧化铝.
解答:
解:(1)阴离子:质子数=核外电子数-电荷数=10-3=7,故该元素为N,单质为N2,电子数为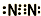 ,故答案为:
,故答案为: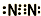 ;
;
(2)阴离子:质子数=核外电子数-电荷数=10-1=9,故该元素为F,单质为F2,水反应的化学方程式为:2F2+2H2O=O2+4HF,
故答案为:2F2+2H2O=O2+4HF;
(3)阴离子:质子数=核外电子数-电荷数=10-2=8,故该元素为O,其氢化物为水,结构式为H-O-H,
故答案为:H-O-H;
(4)第三周期,离子半径最小的是铝离子,其最高价氧化物对应的水化物为氢氧化铝,氢氧化铝与强碱反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
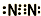 ,故答案为:
,故答案为: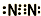 ;
;(2)阴离子:质子数=核外电子数-电荷数=10-1=9,故该元素为F,单质为F2,水反应的化学方程式为:2F2+2H2O=O2+4HF,
故答案为:2F2+2H2O=O2+4HF;
(3)阴离子:质子数=核外电子数-电荷数=10-2=8,故该元素为O,其氢化物为水,结构式为H-O-H,
故答案为:H-O-H;
(4)第三周期,离子半径最小的是铝离子,其最高价氧化物对应的水化物为氢氧化铝,氢氧化铝与强碱反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评:本题考查离子结构示意图、电子式、结构式等化学用语及相关反应方程式的书写,难度不大.要注意阴离子:质子数=核外电子数-电荷数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
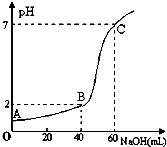 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )| A、所用HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1 |
| B、在B点,溶液中离子浓度关系为:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、A、B、C三点水的电离程度大小依次为:A>B>C |
| D、滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
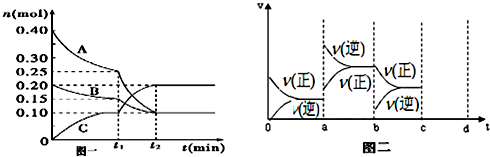
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表: 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=