题目内容
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4
2PbSO4+2H2O,现以铅蓄电池作电源,用惰性电极电解100mL 4mol?L-1 Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12L.
(1)铅蓄电池中消耗的硫酸为 mol;
(2)停止电解,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+的物质的量浓度为 mol/L(设溶液的体积不变).
| 放电 |
| 充电 |
(1)铅蓄电池中消耗的硫酸为
(2)停止电解,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+的物质的量浓度为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)用惰性电极电解100mL 4mol?L-1 Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12L,阳极上氢氧根离子放电生成氧气,则生成1.12L氧气转移电子的物质的量=
×4=0.2mol,
根据转移电子相等计算消耗硫酸的物质的量;
(2)根据转移电子相等析出n(Cu)=
=0.1mol,生成硝酸的物质的量=2n(Cu)=0.2mol,剩余n(Cu 2+ )=4mol/L×0.1L=0.4mol,则溶液中还剩余n(Cu 2+ )=0.4mol-0.1mol=0.3mol,铁和硝酸、铜离子发生氧化还原反应生成亚铁离子,据此解答.
| 1.12L |
| 22.4L/mol |
根据转移电子相等计算消耗硫酸的物质的量;
(2)根据转移电子相等析出n(Cu)=
| 0.2mol |
| 2 |
解答:
解:(1)用惰性电极电解100mL 4mol?L-1 Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12L,阳极上氢氧根离子放电生成氧气,则生成1.12L氧气转移电子的物质的量=
×4=0.2mol,根据转移电子相等得消耗硫酸的物质的量=
×2=0.2mol,故答案为:0.2;
(2)根据转移电子相等析出n(Cu)=
=0.1mol,生成硝酸的物质的量=2n(Cu)=0.2mol,剩余n(Cu 2+ )=4mol/L×0.1L=0.4mol,则溶液中还剩余n(Cu2+)=0.4mol-0.1mol=0.3mol,铁和硝酸、铜离子发生氧化还原反应生成亚铁离子,和铜离子反应的n(Fe)=n(Cu2+)=0.3mol,和硝酸反应的n(Fe)=
×3=0.075mol,则Fe2+的物质的量浓度=
=3.75mol/L,
故答案为:3.75.
| 1.12L |
| 22.4L/mol |
| 0.2mol |
| 2 |
(2)根据转移电子相等析出n(Cu)=
| 0.2mol |
| 2 |
| 0.2mol |
| 8 |
| 0.3mol+0.075mol |
| 0.1L |
故答案为:3.75.
点评:本题以原电池原理为载体考查了物质的量的有关计算,明确反应中各个物理量之间的关系式计算,注意(2)中还有铜离子剩余,为易错点.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
| B、天然纤维和人造纤维的主要成分都是纤维素 |
| C、发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品 |
| D、NaHCO3能与酸反应,因此食品工业用小苏打做焙制糕点的膨松剂 |
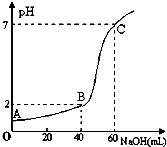 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )| A、所用HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1 |
| B、在B点,溶液中离子浓度关系为:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、A、B、C三点水的电离程度大小依次为:A>B>C |
| D、滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
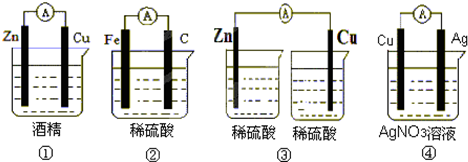
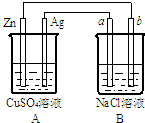 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.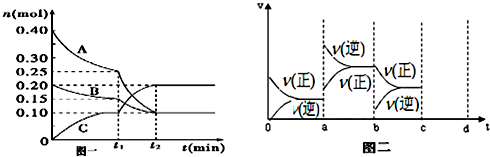
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表: