题目内容
3.向硝酸钠溶液中加入铜粉,不发生反应,若再加入某种盐,则铜粉可以逐渐溶解.符合此条件的盐是( )| A. | 碳酸氢钠 | B. | 硫酸锌 | C. | 硝酸铁 | D. | 氯化钠 |
分析 再加入某种盐,具有氧化性或在酸性溶液中Cu、硝酸根离子发生氧化还原反应,铜粉可以逐渐溶解,以此来解答.
解答 解:A、B、D中物质均与Cu不反应,不能溶解,只有选项C中硝酸铁与Cu发生氧化还原反应生成硝酸铜、硝酸亚铁,铜粉可以逐渐溶解,
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下面叙述正确的是( )
| A. | 蔗糖遇浓硫酸可发生碳化现象,但与稀硫酸则不会发生反应 | |
| B. | 因为纤维素结构中有羟基,所以它能与醋酸发生酯化反应,生成乙酸纤维素酯 | |
| C. | 除去淀粉中的葡萄糖杂质,可用加水渗析的方法 | |
| D. | 将淀粉与水在酸作用下加热水解,在滴入碘酒不变蓝时表示水解完全,即可停止加热 |
14.以下物质间的每步转化通过一步反应不能实现的是( )
| A. | S→SO3→H2SO4→SO2 | B. | N2→NO→NO2→HNO3 | ||
| C. | Na→Na2O→NaOH→Na2CO3 | D. | Al→Al2O3→Al2(SO4)3→Al(OH)3 |
11.下列说法不正确的是( )
| A. | 铅蓄电池在放电过程中,电池反应液的pH将变小 | |
| B. | 相同条件下,结合质子的能力:OH->ClO->CH3COO- | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 | |
| D. | 在氯化银悬浊液中加入NaBr溶液,沉淀由白色转变为淡黄色,说明Ksp(AgCl)>Ksp(AgBr) |
18.镁有三种同位素24Mg、25Mg、26Mg,氯有两种天然同位素35Cl、37Cl,那么氯化镁的相对分子质量的数值应有( )
| A. | 3种 | B. | 5种 | C. | 7种 | D. | 9种 |
8.下列气体不能用排气法收集的是( )
| A. | Cl2 | B. | CO2 | C. | NH3 | D. | NO |
15.分析右面的能量变化示意图,下列选择正确的是( )


| A. | 2A+B→2C+Q | B. | 2C→2A+B-Q | C. | 2A(g)+B(g)→2C(g)-Q | D. | 2A(g)+B(g)→2C(g)+Q |
12.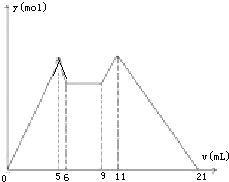 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是盐酸,B是NaOH,且C(NaOH)=2C(HCl) | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
13.下列有关物质的表达式正确的是( )
| A. | 乙炔分子比例模型: | B. | 乙烯分子的结构简式为CH2CH2 | ||
| C. | 一氯甲烷的电子式为: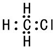 | D. | 2-甲基丁烷的键线式: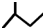 |