题目内容
12.有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.(1)A分子的质谱图如图所示,从图中可知其相对分子质量为90,则A的分子式是C3H6O3;

(2)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况),实验结论:A中所含有官能团的名称为羧基、羟基;
(3)物质A的核磁共振氢谱如上图所示,则A的结构简式CH3CH(OH)COOH;
(4)请写出与A含有相同官能团的同分异构体的结构简式CH2OHCH2COOH.
分析 5.4g水的物质的量为$\frac{5.4g}{18g/mol}$=0.3mol,n(H)=0.6 mol,13.2g二氧化碳的物质的量为$\frac{13.2g}{44g/mol}$=0.3mol,n(C)=n(CO2)=0.3 mol,此有机物9.0g含O元素质量:9.0g-0.6g-0.3×12 g=4.8 g,n(O)=$\frac{4.8g}{16g/mol}$=0.3 mol,故n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,即实验式为CH2O,设分子式为(CH2O)n,A的相对分子质量为90,可得30n=90,解得:n=3,故有机物A为C3H6O3,A分子的核磁共振氢谱有4个吸收峰,峰面积之比是1:1:1:3,应为CH3CH(OH)COOH,以此解答该题.
解答 解:(1)由质谱图可知有机物的相对分子质量为90,5.4g水的物质的量为$\frac{5.4g}{18g/mol}$=0.3mol,n(H)=0.6 mol,13.2g二氧化碳的物质的量为$\frac{13.2g}{44g/mol}$=0.3mol,n(C)=n(CO2)=0.3 mol,此有机物9.0g含O元素质量:9.0g-0.6g-0.3×12 g=4.8 g,n(O)=$\frac{4.8g}{16g/mol}$=0.3 mol,故n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,即实验式为CH2O,设分子式为(CH2O)n,A的相对分子质量为90,可得30n=90,解得:n=3,故有机物A为C3H6O3;
故答案为:90;C3H6O3;
(2)A能与NaHCO3溶液发生反应,A一定含有羧基(-COOH);若与足量金属钠反应则生成2.24L H2(标准状况),可知还应含有羟基,
故答案为:羧基、羟基;
(3)有机物A为C3H6O3,核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则分子中4种H原子的数目为1、1、1、3,分子中含有1个-COOH、1个-CH3、1个 CH、1个-OH,有机物A的结构简式为CH3CH(OH)COOH;
CH、1个-OH,有机物A的结构简式为CH3CH(OH)COOH;
故答案为:CH3CH(OH)COOH;
(4)官能团与A相同的同分异构体的结构简式为CH2OHCH2COOH,故答案为:CH2OHCH2COOH.
点评 本题考查有机物的推断,侧重于学生的分析、计算能力的考查,题目涉及分子式与结构式的确定、官能团的性质等知识,题目难度中等,注意把握燃烧法及质量守恒确定有机物分子式的方法,明确常见有机物结构与性质.

 金钥匙试卷系列答案
金钥匙试卷系列答案
下列说法正确的是( )
| A. | 原溶液中c(Cl-)≥0.1mol•L-1 | |
| B. | 取滤液,加硝酸银溶液,若产生白色沉淀,证明原溶液中存在Cl- | |
| C. | 原溶液一定存在CO32-和SO42-,一定不存在Na+ | |
| D. | 原溶液可能存在Cl-,不存在Fe3+ |
①能分别与CH3CH2OH和CH3COOH反应;
②脱水生成一种能使溴水褪色的物质,此物质只存在一种结构简式;
③能生成一种分子式为C4H6O2的五元环状化合物.
则C4H8O3的结构简式为( )
| A. | HOCH2CH2CH2COOH | B. | CH3CH(OH)CH2COOH | C. | HOCH2COOCH2CH3 | D. | CH3CH2CH(OH)COOH |
①用分液法分离苯和溴苯的混合物
②用结晶法分离硝酸钾和氯化钠的混合物
③用分液法分离水和硝基苯的混合物
④用蒸馏法分离乙醇(沸点为78.5℃)和乙酸乙酯(沸点为77.5℃)的混合物.
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ②④ |
| A. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| B. | 将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| C. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
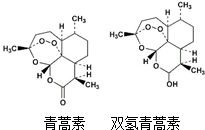 双氢青蒿素的抗疟疗效是青蒿素的10倍,其结构如图所示,下列说法中错误的是( )
双氢青蒿素的抗疟疗效是青蒿素的10倍,其结构如图所示,下列说法中错误的是( )| A. | 双氢青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧链和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
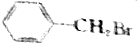 ②CH3CH2CH3Br ③CH3Br ④CH3CHBrCH2CH3
②CH3CH2CH3Br ③CH3Br ④CH3CHBrCH2CH3
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$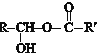
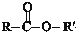 $?_{△}^{催化剂}$
$?_{△}^{催化剂}$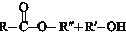
 .
. .
.