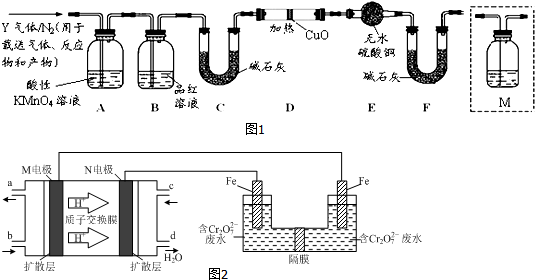
题目内容
4.合成纤维Z的吸湿性接近于棉花.合成Z的流程图如图所示: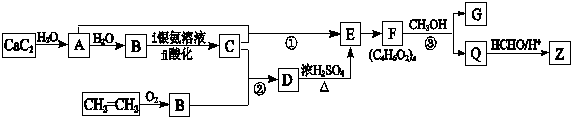
已知:下列反应中R、R′、R″代表烃基
Ⅰ.
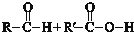 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$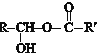
Ⅱ.
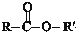 $?_{△}^{催化剂}$
$?_{△}^{催化剂}$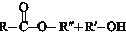
Ⅲ.2R-OH$\stackrel{HCHO/H+}{→}$RO-CH2-OR
(1)A的结构简式是CH≡CH.
(2)B的分子式为C2H4O,其官能团的名称是醛基.
(3)反应①的化学方程式是
 .
.(4)下列说法正确的是acd.(填字母)
a.D→E的反应类型为消去反应b.D能与Na、NaOH、NaHCO3反应
c.Q分子中含有-OHd.G在酸性或碱性环境中均能水解
(5)E有多种同分异构体,与E具有相同官能团的有5种(含顺反异构体,不包括E),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是HCOOC(CH3)=CH2.
(6)合成纤维Z含有六元环状结构,Z的结构简式是
 .
.
分析 碳化钙溶于水生成A,A是乙炔,乙炔和水加成生成B,B是乙醛,乙醛发生银镜反应生成C,C是乙酸.根据信息I可知D的结构简式为CH3COOCHOHCH3,D通过消去反应生成E,结构简式为CH3COOCH=CH2,E中含有碳碳双键,可发生加聚反应生成F,F为 ,由信息Ⅱ可知G、Q分别为CH3COOCH3、
,由信息Ⅱ可知G、Q分别为CH3COOCH3、 ,根据信息Ⅲ及Z中含有六元环状结构可知Z的结构简式为
,根据信息Ⅲ及Z中含有六元环状结构可知Z的结构简式为 ,结合对应有机物的性质以及题目要求可解答该题.
,结合对应有机物的性质以及题目要求可解答该题.
解答 解:碳化钙溶于水生成A,A是乙炔,乙炔和水加成生成B,B是乙醛,乙醛发生银镜反应生成C,C是乙酸.根据信息I可知D的结构简式为CH3COOCHOHCH3,D通过消去反应生成E,结构简式为CH3COOCH=CH2,E中含有碳碳双键,可发生加聚反应生成F,F为 ,由信息Ⅱ可知G、Q分别为CH3COOCH3、
,由信息Ⅱ可知G、Q分别为CH3COOCH3、 ,根据信息Ⅲ及Z中含有六元环状结构可知Z的结构简式为
,根据信息Ⅲ及Z中含有六元环状结构可知Z的结构简式为 ,
,
(1)由以上分析可知A为CH≡CH,故答案为:CH≡CH;
(2)B是乙醛,含有的官能团为醛基,故答案为:醛基;
(3)E结构简式为CH3COOCH=CH2,C为乙酸,与乙炔反应的方程式为 ,
,
故答案为: ;
;
(4)a.D的结构简式为CH3COOCHOHCH3,D通过消去反应生成E,故a正确;
b.D的结构简式为CH3COOCHOHCH3,含有酯基,可在碱性条件下水解,含有-OH,可与钠反应生成氢气,但不含羧基,不具有酸性,不能与NaHCO3反应,故b错误;
c.Q为 ,含有亲水基,是一种水溶性很好的高分子化合物,故c正确;
,含有亲水基,是一种水溶性很好的高分子化合物,故c正确;
d.G为CH3COOCH3,含有酯基,在酸性或碱性环境中均能水解,故d正确.
故答案为:acd;
(5)E为CH3COOCH=CH2,与E具有相同官能团的有5种,分别为HCOOCH=CHCH3(含有顺反异构)、HCOOCH2CH=CH2、HCOOC(CH3)=CH2、CH2=CHCOOCH3,其中HCOOC(CH3)=CH2核磁共振氢谱有3组吸收峰,且能发生银镜反应,
故答案为:5;HCOOC(CH3)=CH2;
(6)由以上分析可知Z为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,综合考查有机物的结构和性质,侧重于学生分析能力和综合运用化学知识的能力,解答该题的突破口为A,可用正推法推断,题目难度中等.

| A. | 所含分子数相等 | B. | 分子间的平均距离相等 | ||
| C. | 分子中的电子总数相等 | D. | 氧原子数相等 |
| A. | 10gH2和10gO2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.5molBr2 | D. | 22.4mLH2(标准状况)和0.1molN2 |
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 多于12种 |
| A. | 甲烷与乙烯互为同系物 | |
| B. | 32S与33S是同种核素 | |
| C. | O2与O3互为同位素 | |
| D. | 乙醇和二甲醚(CH3-O-CH3)互为同分异构体 |