题目内容
10.请根据官能团的不同对下列有机物进行分类.①CH3CH2OH醇类 ②
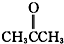 酮类 ③CH3CH2Br卤代烃
酮类 ③CH3CH2Br卤代烃④
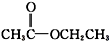 酯类 ⑤
酯类 ⑤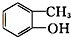 酚类 ⑥
酚类 ⑥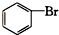 卤代烃
卤代烃⑦
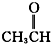 醛类 ⑧
醛类 ⑧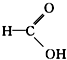 羧酸类 ⑨
羧酸类 ⑨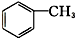 芳香烃.
芳香烃.
分析 有机物官能团可确定有机物的种类,常见有机物有烯烃、炔烃、卤代烃、醇、酚、醛、酸、酯等,结合有机物的结构简式判断有机物的种类,以此解答.
解答 解:①CH3CH2OH 为乙醇,属于醇类;
②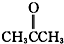 为丙酮,属于酮类;
为丙酮,属于酮类;
③CH3CH2Br为溴乙烷,属于卤代烃;
④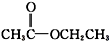 为乙酸乙酯,属于酯类;
为乙酸乙酯,属于酯类;
⑤ 为邻甲基苯酚,属于酚类;
为邻甲基苯酚,属于酚类;
⑥ 为溴苯,属于卤代烃;
为溴苯,属于卤代烃;
⑦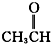 为甲醛,属于醛类;
为甲醛,属于醛类;
⑧ 为甲酸,属于酸类;
为甲酸,属于酸类;
⑨ 为甲苯,属于芳香烃.
为甲苯,属于芳香烃.
故答案为:①醇类;②酮类;③卤代烃;④酯类;⑤酚类;⑥卤代烃;⑦醛类;⑧羧酸类;⑨芳香烃.
点评 本题考查有机物的官能团及其结构,难度不大,注意把握有机物的结构特点和官能团的结构和性质,学习中注意把握有机物的类别和性质.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
1.将盛有N2和NO2的混合气体的试管倒立于水中经过充分反应后,气体体积减少为原来的一半,则原混合气体中N2和NO2的体积比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
18.下列化学变化属于加成反应的是( )
| A. | 乙醇在铜作催化剂的条件下加热和空气的反应 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 甲烷在光照条件下与氯气发生的反应 | |
| D. | 苯与液溴在铁粉作催化剂的条件下发生的反应 |
5.下列卤代烃发生消去反应后,可以得到两种烯烃的是( )
| A. | 2-甲基-2-氯丙烷 | B. | 3-氯戊烷 | C. | 2-溴丁烷 | D. | 1-氯丁烷 |
4.将足量的稀盐酸加到由下列物质组成的固体混合物中,只能发生一种类型反应的是( )
| A. | Al、Cu、AgNO3 | B. | Na2O2、Na2SO3、BaCl2 | ||
| C. | CaCO3、Na2SiO3、CH3COONa | D. | Ba(NO3)2、Fe(OH)2、NaOH |
11.下列叙述中错误的是( )
| A. | 随着电子层数增多,碱金属的原子半径逐渐增大 | |
| B. | 碱金属具有强还原性,它们的离子具有强氧化性 | |
| C. | 碱金属单质的熔沸点随着核电荷数的增大而降低 | |
| D. | 碱金属元素在自然界中都是以化合态存在的 |
8.某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质溴.
(3)装置C的作用是吸收尾气,C中盛放的药品是NaOH溶液.
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(5)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
实验记录如下:
| 实验操作 | 现象及结论 | |
| Ⅰ | 打开活塞a,滴加氯水,关闭活塞 | A中溶液变为红棕色 |
| Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
| Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |

(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质溴.
(3)装置C的作用是吸收尾气,C中盛放的药品是NaOH溶液.
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(5)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
9.下列粒子半径大小比较,正确的是( )
| A. | Na+<Mg2+<Al3+<K+ | B. | S2->Cl->K+>Ca2+ | ||
| C. | Cl>S>F>O | D. | S2->O2->Cl->Br- |