题目内容
2.下列溶液中硫酸根离子浓度与50ml 3mol/L Mg SO4溶液中硫酸根离子浓度相同的是( )| A. | 150ml 1mol/L Na2 SO4 | B. | 150ml 1.5mol/LKAl (SO4)2 | ||
| C. | 500ml 0.3mol/L Fe SO4 | D. | 50ml 3mol/L Fe2 (SO4)3 |
分析 3mol/L Mg SO4溶液中硫酸根离子浓度为3mol/L,结合溶质浓度及物质构成计算离子浓度,以此来解答.
解答 解:A.1mol/L Na2 SO4中硫酸根离子浓度为1mol/L,故A不选;
B.1.5mol/LKAl (SO4)2中硫酸根离子浓度为1.5mol/L×2=3mol/L,故B选;
C.0.3mol/L Fe SO4中硫酸根离子浓度为0.3mol/L,故C不选;
D.3mol/L Fe2 (SO4)3中硫酸根离子浓度为3mol/L×3=9mol/L,故D不选;
故选B.
点评 本题考查物质的量浓度的计算,为高频考点,把握离子浓度与溶质浓度的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.

练习册系列答案
相关题目
8.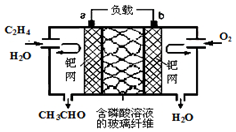 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该装置能量转化形式是电能转化为化学能 | |
| B. | 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+ | |
| C. | 每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
13.白磷的化学式写成P,但其实际组成为P4,而三氧化二磷其实是以六氧化四磷的形式存在的,已知P4O6分子中只含有单键,且每个原子的最外层都满足8电子结构,则分子中含有的共价键的数目是( )
| A. | 10 | B. | 12 | C. | 24 | D. | 28 |
10.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )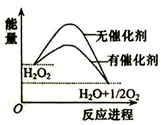

| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+O2 △H<0 | |
| D. | 断键吸收的总能量小于成键放出的总能量 |
17. 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其他均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其他均为Cu电极,则下列叙述正确的是( )
 某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其他均为Cu电极,则下列叙述正确的是( )
某同学组装了如图所示的电化学装置,电极Ⅰ为Al电极,其他均为Cu电极,则下列叙述正确的是( )| A. | 电流方向:电极Ⅰ→ →电极Ⅳ →电极Ⅳ | B. | 电极Ⅰ发生氧化反应 | ||
| C. | 电极Ⅱ质量不变 | D. | 电极Ⅲ的电极反应:2H++2e-═H2↑ |
7.下列离子方程式正确是( )
| A. | 碳酸氢钠与过量的氢氧化钙溶液反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| B. | 过氧化钠与水的反应:2 O22-+2H2O═4 OH-+O2↑ | |
| C. | 碳酸钙加入醋酸CO32-+2CH3COOH═CO2↑+2CH3COO-+H2O | |
| D. | 铁与稀盐酸的反应:2Fe+6H+═2Fe3++3H2↑ |
14.下列各组溶液中,能用酸式滴定管取用的是( )
| A. | HF | B. | NaHCO3 | C. | HCl | D. | NaHSO3 |
 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如图:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如图: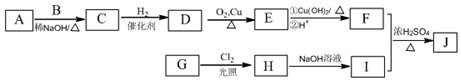
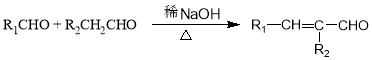
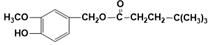 .
.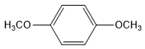 (写结构简式).
(写结构简式).