题目内容
11.按要求回答下列问题:(1)将28.5g氯化镁溶于水配成的500mL溶液中Cl-浓度是1.2mol/L,写出氯化镁的电离方程式MgCl2=Mg2++2Cl-.
(2)已知m mol某气体的质量为a g,则b g该气体在标准状况下的体积为$\frac{22.4mb}{a}$L.
(3)某Al2(SO4)3溶液V mL中含有Al3+a g,取出$\frac{V}{4}$ mL溶液稀释成V mL后,SO42-的物质的量浓度为
$\frac{125a}{9V}$mol/L(用含a、V的代数式表示,化简到最简整数比).
(4)以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④铝 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融KNO3,其中属于电解质的是①③⑤⑧(填编号,下同),能导电的是④⑧.
分析 (1)n(MgCl2)=$\frac{28.5g}{95g/mol}$=0.3mol,氯化镁是可溶性盐,在水溶液中完全电离,根据Cl原子守恒得c(Cl-)=2c(MgCl2)=2×$\frac{n(MgCl{\;}_{2})}{V}$,据此分析解答;
(2)根据M=$\frac{m}{n}$计算气体的摩尔质量,再根据n=$\frac{m}{M}$计算气体物质的量,根据V=nVm计算气体体积;
(3)根据n=$\frac{m}{M}$计算ag Al3+的物质的量,进而计算$\frac{V}{4}$ mL溶液中Al3+的物质的量,根据电荷守恒可知2n(SO42-)=3n(Al3+),据此计算$\frac{V}{4}$ mL溶液中SO42-的物质的量,稀释为VmL,溶液中SO42-的物质的量不变,再根据c=$\frac{n}{V}$计算稀释后溶液SO42-的物质的量浓度;
(4)水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;
单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质;
能导电的物质--必须具有能自由移动的带电的微粒,金属能导电--是由于金属中存在能自由移动的带负电的电子,据此分析.
解答 解:(1)n(MgCl2)=$\frac{28.5g}{95g/mol}$=0.3mol,氯化镁是可溶性盐,在水溶液中完全电离,电离方程式为:MgCl2=Mg2++2Cl-,根据Cl原子守恒得c(Cl-)=2c(MgCl2)=2×$\frac{n(MgCl{\;}_{2})}{V}$=2×$\frac{0.3mol}{0.5L}$=1.2mol/L,
故答案为:1.2mol/L;MgCl2=Mg2++2Cl-;
(2)m mol某气体的质量为a g,则该气体摩尔质量为$\frac{ag}{mmol}$=$\frac{a}{m}$g/mol,
b g该气体的物质的量为$\frac{b}{\frac{a}{m}}$=$\frac{mb}{a}$mol
在标准状况下,该气体的体积为$\frac{mb}{a}$mol×22.4L/mol=$\frac{22.4mb}{a}$L,
故答案为:$\frac{22.4mb}{a}$;
(3)ag Al3+的物质的量为$\frac{a}{27}$mol,故$\frac{V}{4}$ mL溶液中Al3+的物质的量为$\frac{a}{27}$mol×$\frac{1}{4}$=$\frac{a}{108}$mol,
根据电荷守恒可知2n(SO42-)=3n(Al3+),故$\frac{V}{4}$ mL溶液中SO42-的物质的量为$\frac{a}{108}$mol×$\frac{3}{2}$=$\frac{a}{72}$mol,
取$\frac{V}{4}$ mL溶液稀释到V mL,则稀释后溶液SO42-的物质的量浓度为$\frac{\frac{a}{72}}{V×10{\;}^{-3}}$=$\frac{125a}{9V}$mol/L,
故答案为:$\frac{125a}{9V}$mol/L;
(4)①NaCl晶体在水溶液中或熔融状态下能够导电,是电解质,但固体状态下不能够导电;
②液态SO3是共价化合物不能导电,也不是电解质;
③液态的醋酸是电解质但要溶于水才能导电,液态下不导电;
④铝是金属单质能导电,但单质不是电解质;
⑤BaSO4固体在熔融状态下能够导电,是电解质,但固体状态下不能够导电;
⑥蔗糖(C12H22O11)是非电解质,没有离子,不导电;
⑦酒精(C2H5OH)也是非电解质,不导电;
⑧熔化KNO3能导电,是电解质;
所以属于电解质的是①③⑤⑧,能导电的是④⑧;
故答案为:①③⑤⑧;④⑧.
点评 本题考查物质的量有关计算以及电解质、导电性的判断,为高频考点,比较基础,关键是掌握以物质的量为中心的有关计算公式,注意单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质.

| A. | 150ml 1mol/L Na2 SO4 | B. | 150ml 1.5mol/LKAl (SO4)2 | ||
| C. | 500ml 0.3mol/L Fe SO4 | D. | 50ml 3mol/L Fe2 (SO4)3 |
| A. | 次氯酸 | B. | 细铁丝 | C. | 氯水 | D. | 干冰 |
| A. | 把铁片插入CuSO4溶液中,验证古代湿法冶铜:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 某气体使澄清石灰水先变浑浊后变澄清,验证该气体是CO2:Ca2++2OH-+CO2═CaCO3↓+H2O、CaCO3+CO2+H2O═Ca2++2HCO3- | |
| C. | 在小苏打溶液中加入醋酸,验证醋酸比碳酸的酸性强:HCO3-+H+═CO2↑+H2O | |
| D. | 若要求用两种单质和一种溶液来测定Zn、Cu、Ag三种金属的活动性顺序,可用Zn、Cu和AgNO3:Zn+2Ag+═Zn2++2Ag |
| A. | 锌为负极,二氧化锰为正极 | |
| B. | 锌为正极,二氧化锰为负极 | |
| C. | 工作时电子由二氧化锰经外电路流向锌极 | |
| D. | 锌电极发生还原反应,二氧化锰发生氧化反应 |
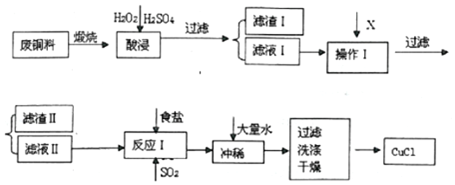
| 物质 | 开始沉淀pH | 沉淀完全pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Fe(OH)2 | 7.6 | 9.6 |
(1)酸浸液中加入足量H2O2的主要目的是将Fe2+完全氧化为Fe3+,便于转化为Fe(OH)3沉淀除去.
(2)滤渣I的主要成分是SiO2.
(3)操作I调节溶液的pH范围为4.7≤pH≤5.6,加入的物质X可以是ABCD.
A.CuO B.Cu(OH)2 C.NaOH溶液 D.Cu2(OH)2CO E.Cu
(4)往滤液 II中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式2H2O+2Cu2++SO2+4Cl-=2CuCl2-+SO42-+4H+.
(5)过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.于70℃真空干燥的目的是:加快乙醇和水的蒸发,防止CuCl被空气氧化.
(6)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠50粒和10mL过量的FeCl3溶液250mL锥形瓶中,不断摇动:玻璃珠的作用是加速样品的溶解.
②待样品溶解后,加水50mL,并加入邻菲罗啉指示剂2滴:
③立即用0.10mol•L-1硫酸铈标准溶液滴至终点:同时做空白实验一次.
己知:上述过程发生的反应①CuCl+FeCl3═CuCl2+FeCl2③Fe2++Ce4+═Fe3++Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.75 | 24.85 | 24.80 |
(说明:空白实验是在不加样品的情况下,用测定样品相同的方法、步骤进行定量分析,把所得结果作为空白值,从样品的分析结果中扣除.这样可以消除由于试剂不纯或试剂干扰等所造成的系统误差.)
| 选项 | 现象或事实 | 解释 |
| A | 铝箔在酒精灯上加热,熔化后的液态铝不滴落 | 高熔点的氧化铝薄膜兜在铝的外面,阻止了液态铝滴落 |
| B | 铁放在冷的浓硝酸中不溶解,无红棕色气体生成 | 铁遇浓硝酸钝化,表面形成致密的氧化膜,阻止内部铁继续与硝酸反应 |
| C | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| D | 将新制氯水滴到蓝色石蕊试纸上,试纸先变红后褪色 | 新制氯水中的H+使石蕊试纸先变红,HClO的强氧化性使石蕊试纸褪色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 二氧化硫和氯气都能使品红溶液褪色 | |
| B. | 漂白粉暴露在空气中久置会变质 | |
| C. | 在加热条件下,镁能在二氧化碳气体中燃烧 | |
| D. | 氯水中真正起漂白、杀菌、消毒作用的微粒是其中含有的Cl2分子 |