题目内容
14.下列各组溶液中,能用酸式滴定管取用的是( )| A. | HF | B. | NaHCO3 | C. | HCl | D. | NaHSO3 |
分析 滴定管分为酸式滴定管和碱式滴定管,酸式滴定管用于量取酸性溶液或具有强氧化性的溶液,如硫酸、盐酸、酸性高锰酸钾溶液等,据此进行解答.
解答 解:A.HF具有很强腐蚀性,不能用酸式滴定管量取,故A错误;
B.NaHCO3溶液呈碱性,应该用碱式滴定管量取,故B错误;
C.HCl溶液呈酸性,需要用酸式滴定管量取,故C正确;
D.NaHSO3溶液呈酸性,需要用酸式滴定管量取,故D正确;
故选CD.
点评 本题考查了常见计量仪器的构造及使用方法,题目难度不大,明确常见化学仪器的构造为解答关键,A为易错点,注意HF具有腐蚀性,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
20.乙酰水杨酸是一种常见的解热镇痛药,结构简式如图所示.下列有关叙述正确的是( )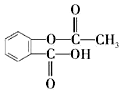

| A. | 乙酰水杨酸的分子式为C9H10O4 | |
| B. | 1mol乙酰水杨酸能与5molH2发生加成反应 | |
| C. | 1mol乙酰水杨酸在NaOH溶液中能与3mol NaOH反应 | |
| D. | 用烃基(-C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体 |
5.下列各组混合物中.能用分液漏斗分离的是( )
| A. | 酒情和水 | B. | 碘和四氯化碳 | ||
| C. | 水和四氯化碳 | D. | 硫单质和二硫化碳 |
2.下列溶液中硫酸根离子浓度与50ml 3mol/L Mg SO4溶液中硫酸根离子浓度相同的是( )
| A. | 150ml 1mol/L Na2 SO4 | B. | 150ml 1.5mol/LKAl (SO4)2 | ||
| C. | 500ml 0.3mol/L Fe SO4 | D. | 50ml 3mol/L Fe2 (SO4)3 |
19.下列物质属于电解质的是( )
| A. | 次氯酸 | B. | 细铁丝 | C. | 氯水 | D. | 干冰 |
6.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 把铁片插入CuSO4溶液中,验证古代湿法冶铜:2Fe+3Cu2+═2Fe3++3Cu | |
| B. | 某气体使澄清石灰水先变浑浊后变澄清,验证该气体是CO2:Ca2++2OH-+CO2═CaCO3↓+H2O、CaCO3+CO2+H2O═Ca2++2HCO3- | |
| C. | 在小苏打溶液中加入醋酸,验证醋酸比碳酸的酸性强:HCO3-+H+═CO2↑+H2O | |
| D. | 若要求用两种单质和一种溶液来测定Zn、Cu、Ag三种金属的活动性顺序,可用Zn、Cu和AgNO3:Zn+2Ag+═Zn2++2Ag |
3.CuCl是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂,并用于颜料、防腐等工业.工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如图:
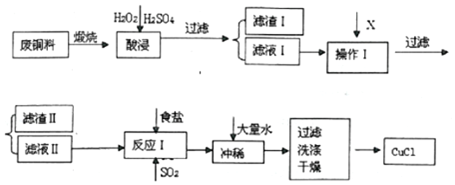
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀.
(1)酸浸液中加入足量H2O2的主要目的是将Fe2+完全氧化为Fe3+,便于转化为Fe(OH)3沉淀除去.
(2)滤渣I的主要成分是SiO2.
(3)操作I调节溶液的pH范围为4.7≤pH≤5.6,加入的物质X可以是ABCD.
A.CuO B.Cu(OH)2 C.NaOH溶液 D.Cu2(OH)2CO E.Cu
(4)往滤液 II中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式2H2O+2Cu2++SO2+4Cl-=2CuCl2-+SO42-+4H+.
(5)过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.于70℃真空干燥的目的是:加快乙醇和水的蒸发,防止CuCl被空气氧化.
(6)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠50粒和10mL过量的FeCl3溶液250mL锥形瓶中,不断摇动:玻璃珠的作用是加速样品的溶解.
②待样品溶解后,加水50mL,并加入邻菲罗啉指示剂2滴:
③立即用0.10mol•L-1硫酸铈标准溶液滴至终点:同时做空白实验一次.
己知:上述过程发生的反应①CuCl+FeCl3═CuCl2+FeCl2③Fe2++Ce4+═Fe3++Ce3+
如此再重复二次测得:
④数据处理:计算得CuCl的纯度为95.52%.(平行实验结果相差不能超过0.3%)
(说明:空白实验是在不加样品的情况下,用测定样品相同的方法、步骤进行定量分析,把所得结果作为空白值,从样品的分析结果中扣除.这样可以消除由于试剂不纯或试剂干扰等所造成的系统误差.)

| 物质 | 开始沉淀pH | 沉淀完全pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Fe(OH)2 | 7.6 | 9.6 |
(1)酸浸液中加入足量H2O2的主要目的是将Fe2+完全氧化为Fe3+,便于转化为Fe(OH)3沉淀除去.
(2)滤渣I的主要成分是SiO2.
(3)操作I调节溶液的pH范围为4.7≤pH≤5.6,加入的物质X可以是ABCD.
A.CuO B.Cu(OH)2 C.NaOH溶液 D.Cu2(OH)2CO E.Cu
(4)往滤液 II中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式2H2O+2Cu2++SO2+4Cl-=2CuCl2-+SO42-+4H+.
(5)过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品.于70℃真空干燥的目的是:加快乙醇和水的蒸发,防止CuCl被空气氧化.
(6)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠50粒和10mL过量的FeCl3溶液250mL锥形瓶中,不断摇动:玻璃珠的作用是加速样品的溶解.
②待样品溶解后,加水50mL,并加入邻菲罗啉指示剂2滴:
③立即用0.10mol•L-1硫酸铈标准溶液滴至终点:同时做空白实验一次.
己知:上述过程发生的反应①CuCl+FeCl3═CuCl2+FeCl2③Fe2++Ce4+═Fe3++Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.75 | 24.85 | 24.80 |
(说明:空白实验是在不加样品的情况下,用测定样品相同的方法、步骤进行定量分析,把所得结果作为空白值,从样品的分析结果中扣除.这样可以消除由于试剂不纯或试剂干扰等所造成的系统误差.)
4.工业上,可用如图所示装置来制取KIO3,则下列有关说法错误的是( )


| A. | 图中膜为阴膜(只允许阴离子通过),OH-从右往左通过该膜 | |
| B. | 电解时,阴极电极反应式为:2H++2e-═H2↑ | |
| C. | 电解时,如有3mol电子通过导线,则一定生成0.6mol KIO3 | |
| D. | 电池总反应为:KI+3H2O $\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑ |