题目内容
10.在一定温度下的恒容密闭容器中,加入等物质的量的A与B物质,A(s)+2B(g)?C(g)+D(g)达到平衡后B的转化率为a,再向容器内加入一定量的B物质达新平衡,下列说法正确的是( )| A. | 若改为加入A物质可加快反应速率 | |
| B. | 达新平衡后B的转化率减小,A的转化率增大 | |
| C. | 达新平衡后A与B的转化率均增大 | |
| D. | 达新平衡后B的转化率不变,A的转化率增大 |
分析 加入等物质的量的A与B物质,A(s)+2B(g)?C(g)+D(g)达到平衡后B的转化率为a,因为A为固体,则再向容器内加入一定量的B物质,相当于增加压强,平衡不移动,所以达新平衡后B的转化率不变,A的转化率增大,据此分析解答.
解答 解:A为固体,加入A物质,反应速率不变,故A错误;
因为A为固体,则再向容器内加入一定量的B物质,相当于增加压强,平衡不移动,所以达新平衡后B的转化率不变,A的转化率增大,故B、C错误,D正确;
故选D.
点评 本题考查反应速率及其转化率的判断,为高频考点,侧重分析与应用能力的考查,注意反应的特点,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
1.下列方程式或说法正确的是( )
| A. | 给氯化铜溶液通电发生的变化为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| B. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O=C6H5OH+HCO3- | |
| C. | 将足量CO2通入含H+、NH4+、Al3+、SO42-中会产生大量的白色沉淀 | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3•H2O+2H2O |
2.下列实验操作与预期实验目的或结论一致的是( )
| 实验操作 | 实验目的或结论 | |
| A | 某钾盐溶于盐酸.产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
| B | 将FeCl2溶液加热蒸发 | 制备FeCl2晶体 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热,得到蓝色溶液 | 蔗糖水解的产物没有还原性 |
| D | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中的少量FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
19.下列说法正确的是( )
| A. | 植物油氢化过程中发生了加成反应 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 环己烷与苯可用酸性KMnO4溶液鉴别 | |
| D. | 水可以用来分离溴苯和苯的混合物 |
15. 改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=$\frac{c(X)}{c({H}_{2}A)+c(H{A}^{-})+c({A}^{2-})}$].下列叙述错误的是( )
改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=$\frac{c(X)}{c({H}_{2}A)+c(H{A}^{-})+c({A}^{2-})}$].下列叙述错误的是( )
 改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=$\frac{c(X)}{c({H}_{2}A)+c(H{A}^{-})+c({A}^{2-})}$].下列叙述错误的是( )
改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=$\frac{c(X)}{c({H}_{2}A)+c(H{A}^{-})+c({A}^{2-})}$].下列叙述错误的是( )| A. | pH=1.2时,c(H2A)=c(HA-) | B. | lg[K2(H2A)]=-4.2 | ||
| C. | PH=2.7时,c(HA-)>c(H2A)=c(A2-) | D. | pH=4.2时,c(HA-)=c(A2-)=c(H+) |
2.古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )
| A. |  瓷器 | B. |  丝绸 | C. |  茶叶 茶叶 | D. |  中草药 中草药 |
5.一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g)?CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
| A. | v生成(CH3OH)=v消耗(CO) | |
| B. | 混合气体的密度不再改变 | |
| C. | 混合气体的平均相对分子质量不再改变 | |
| D. | CO、H2、CH3OH的浓度比为1:2:1 |
 某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
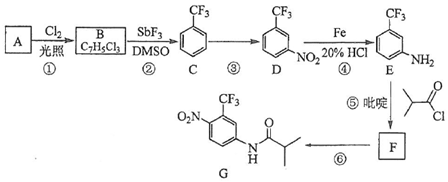
 .C的化学名称是三氟甲苯.
.C的化学名称是三氟甲苯.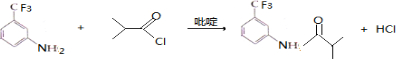 .吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.
.吡啶是一种有机碱,其作用是吸收反应产生的氯化氢,提高反应转化率.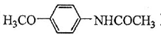 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(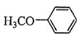 )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线 (其他试剂任选).
(其他试剂任选).