题目内容
1.下列方程式或说法正确的是( )| A. | 给氯化铜溶液通电发生的变化为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| B. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O=C6H5OH+HCO3- | |
| C. | 将足量CO2通入含H+、NH4+、Al3+、SO42-中会产生大量的白色沉淀 | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3•H2O+2H2O |
分析 A、电解氯化铜溶液,阴极铜离子的放电能力比氢离子放电能强,阳极氯离子放电能力强于氢氧根离子;
B、反应生成苯酚和碳酸氢钠;
C、Al3+只有在碱性条件下才能产生白色沉淀;
D、左右两边O元素不守恒.
解答 解:A、阴极铜离子的放电能力比氢离子放电能强,阳极氯离子放电能力强于氢氧根离子,正确的离子方程式为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑,故A错误;
B、苯酚钠溶液中通入少量的CO2气体的离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故B正确;
C、Al3+只有在碱性条件下才能产生白色沉淀,通二氧化碳使溶液呈酸性,并且抑制氨根离子的水解,故溶液中几乎无氨水,故Al3+不能产生大量的白色沉淀,故C错误;
D、由于浓KOH溶液过量,所以NH4HCO3溶液中的NH4+、HCO3-完全反应.故化学方程式:NH4HCO3 +2KOH=K2CO3+NH3↑+2H2O,NH4HCO3 、KOH 和 K2CO3均可以拆,故离子方程式为:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O,故D错误,
故选B.
点评 本题考查离子方程式的书写,明确发生的化学反应为解答的关键,为高考常见题型,注意把握量对反应的影响,注重基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.有关氢氧燃料电池的电极反应,下列说法正确的是( )
| A. | 电解质为NaCl溶液,正极反应为H2+2e-=2H+ | |
| B. | 电解质为NaOH溶液,正极反应为O2+2e-=2OH- | |
| C. | 电解质为HCl溶液,正极反应为O2+4e-+4H+=2H2O | |
| D. | 电解质为Na2CO3溶液,正极反应为H2+2e-+CO32-=H2O+CO2↑ |
12.仅用一种试剂就能区别甲苯、四氯化碳、己烯、乙醇、碘化钾溶液、亚硫酸六种无色液体,则这种试剂是( )
| A. | 双氧水 | B. | 溴水 | C. | 氢氧化钠溶液 | D. | 硝酸银溶液 |
9.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L的CH3Cl中共用电子对数为3NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
16.以下实验操作及现象合理的是( )
| A. | 为检验SO42-需要滴加稀硝酸酸化的BaCl2溶液并观察是否有白色沉淀生成 | |
| B. | 把光洁无锈的铁丝放在煤气灯外焰灼烧至与原来的火焰颜色相同时,蘸取K2CO3溶液并灼烧,透过蓝色钴玻璃可观察到火焰为淡紫色 | |
| C. | 向盛有足量苯酚溶液的试管中滴加少量稀溴水,可观察到白色沉淀生成 | |
| D. | 实验室制备乙炔时,常用NaOH溶液除去产生的H2S、PH3等杂质 |
6.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液吸收H2S:Cu2++S2-=CuS↓ | |
| B. | 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 向饱和碳酸钠溶液中通入足量CO2:CO32-+CO2+H2O=2HCO3- | |
| D. | 向KA1(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
13.下列关于元素性质说法正确的是( )
| A. | Li、C、P分别在氧气中燃烧均能生成两种相应的氧化物 | |
| B. | 除去CO2中混有的SO2气体可选用Na2SO3溶液或NaHCO3溶液 | |
| C. | 过量的铁粉与氯气在点燃条件下充分反应,生成氯化亚铁 | |
| D. | SiO2既可以与氢氟酸反应,又可以与氢氧化钠溶液反应,所以SiO2是两性氧化物 |
10.下列实验操作和所用装置能达到实验目的是( )
| 选项 | A | B | C | D |
| 实验 目的 | 检验蔗糖与浓硫酸反应产物中有CO2 | 证明Fe(NO3)2溶液中存在Fe2+的水解平衡 | 检验某溶液中含有Ag+ | 比较非金属性:S>C>Si |
| 实验 操作 | 将浓硫酸滴入圆底烧瓶中,再将生成的气体通入澄清石灰水 | 将稀硝酸滴入Fe(NO3)2溶液中 | 向待检液中滴加足量的稀盐酸 | 将稀硫酸滴入锥形瓶中,再将生成的气体通入Na2SiO3溶液中 |
| 所用 装置 | 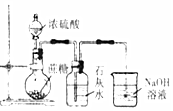 | 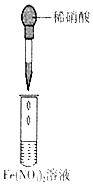 | 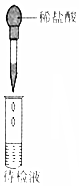 | 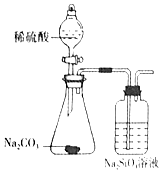 |
| A. | A | B. | B | C. | C | D. | D |
10.在一定温度下的恒容密闭容器中,加入等物质的量的A与B物质,A(s)+2B(g)?C(g)+D(g)达到平衡后B的转化率为a,再向容器内加入一定量的B物质达新平衡,下列说法正确的是( )
| A. | 若改为加入A物质可加快反应速率 | |
| B. | 达新平衡后B的转化率减小,A的转化率增大 | |
| C. | 达新平衡后A与B的转化率均增大 | |
| D. | 达新平衡后B的转化率不变,A的转化率增大 |