题目内容
15. 改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=$\frac{c(X)}{c({H}_{2}A)+c(H{A}^{-})+c({A}^{2-})}$].下列叙述错误的是( )
改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=$\frac{c(X)}{c({H}_{2}A)+c(H{A}^{-})+c({A}^{2-})}$].下列叙述错误的是( )| A. | pH=1.2时,c(H2A)=c(HA-) | B. | lg[K2(H2A)]=-4.2 | ||
| C. | PH=2.7时,c(HA-)>c(H2A)=c(A2-) | D. | pH=4.2时,c(HA-)=c(A2-)=c(H+) |
分析 由图象可知,pH=1.2时,c(H2A)=c(HA-),PH=2.7时,c(H2A)=c(A2-),pH=4.2时,c(HA-)=c(A2-),随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大,结合电离平衡常数以及题给数据计算,可根据纵坐标比较浓度大小,以此解答该题.
解答 解:A.由图象可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),故A正确;
B.pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),K2(H2A)=$\frac{c({A}^{2-})c({H}^{+})}{c(H{A}^{-})}$=10-4.2,则lg[K2(H2A)]=-4.2,故B正确;
C.由图象可知,PH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c(H2A)=c(A2-),故C正确;
D.pH=4.2时,c(HA-)=c(A2-),但此时c(H2A)≈0,如体积不变,则c(HA-)=c(A2-)=0.05mol•L-1,c(H+)=10-4.2mol/L,如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,故D错误.
故选D.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生的分析能力和计算能力,本题注意把握弱电解质的电离特点以及题给图象的曲线变化,难度中等.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
6.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液吸收H2S:Cu2++S2-=CuS↓ | |
| B. | 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 向饱和碳酸钠溶液中通入足量CO2:CO32-+CO2+H2O=2HCO3- | |
| D. | 向KA1(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
7.利用下列实验装置进行相应的实验,不能达到实验目的是( )

| A. | 利用图甲装置,可快速制取氨气 | |
| B. | 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. | 利用图丙装置,可制取乙烯并验证其易酸性KMnO4溶液氧化 | |
| D. | 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
3.下列说法不正确的是( )
| A. | 1mol 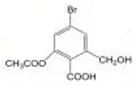 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,最多消耗这三种物质的物质的量分别是2mol、5mol、1mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,最多消耗这三种物质的物质的量分别是2mol、5mol、1mol | |
| B. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别 | |
| C. | 乳酸薄荷醇酯(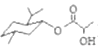 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| D. | 与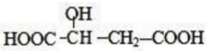 具有官能团种类及数目相同的同分异构体有2种 具有官能团种类及数目相同的同分异构体有2种 |
10.在一定温度下的恒容密闭容器中,加入等物质的量的A与B物质,A(s)+2B(g)?C(g)+D(g)达到平衡后B的转化率为a,再向容器内加入一定量的B物质达新平衡,下列说法正确的是( )
| A. | 若改为加入A物质可加快反应速率 | |
| B. | 达新平衡后B的转化率减小,A的转化率增大 | |
| C. | 达新平衡后A与B的转化率均增大 | |
| D. | 达新平衡后B的转化率不变,A的转化率增大 |
20. 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )| A. | Ka2(H2X)的数量级为10-6 | |
| B. | 曲线N表示pH与lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$的变化关系 | |
| C. | NaHX溶液中c(H+)>c(OH-) | |
| D. | 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
7.聚维酮碘的水溶液是一种常见的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下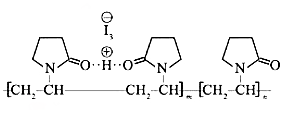 (图中虚线表示氢键)
(图中虚线表示氢键)
下列说法不正确的是( )
 (图中虚线表示氢键)
(图中虚线表示氢键)下列说法不正确的是( )
| A. | 聚维酮的单体是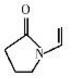 | |
| B. | 聚维酮分子由(m+n)个单体聚合而成 | |
| C. | 聚维酮碘是一种水溶性物质 | |
| D. | 聚维酮在一定条件下能发生水解反应 |
4.根据元素周期表和元素周期律,判断下列叙述不正确的是( )
| A. | 气态氢化物的稳定性:H2O>NH3>SiH4 | |
| B. | 氢元素与其他元素可形成共价化合物或离子化合物 | |
| C. |  如图所示实验可证明元素的非金属性:Cl>C>Si | |
| D. | 用中文“ ”(ào)命名的第118号元素在周期表中位于第七周期0族 ”(ào)命名的第118号元素在周期表中位于第七周期0族 |
10.下列行为中符合安全要求的是( )
| A. | 进入煤矿井时,用火把照明 | |
| B. | 用点燃的火柴在煤气炉灶处检验是否漏气 | |
| C. | 用水浇灭钠等金属的着火 | |
| D. | 在大型庆祝活动场地,可以放充氦气的气球 |