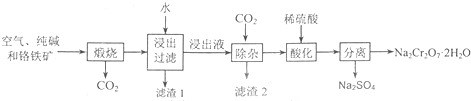
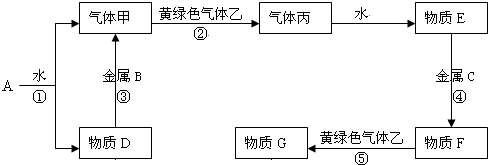
题目内容
为探究某抗酸药X的组成,进行如下实验:
查阅资料:
①抗酸药X可能的组成可以表示为:MgmAln(OH)p(CO3)q(SiO3)r(m、n、p、q、r为≥0的整数).
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,pH=11.4时沉淀完全.
实验过程:
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是 .
(2)Ⅱ中生成B反应的离子方程式是 .
(3)Ⅲ中B溶解反应的离子方程式是 .
(4)沉淀C的化学式是 .
(5)若上述n(A):n(B):n(C)=1:2:3,则X的化学式是 .
查阅资料:
①抗酸药X可能的组成可以表示为:MgmAln(OH)p(CO3)q(SiO3)r(m、n、p、q、r为≥0的整数).
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,pH=11.4时沉淀完全.
实验过程:
| 步骤 | 实验操作 | 实验现象 |
| Ⅰ | 向X的粉末中加入过量盐酸 | 产生气体A,得到无色溶液 |
| Ⅱ | 向Ⅰ所得的溶液中滴加氨水,调节pH至5~6,过滤 | 生成白色沉淀B |
| Ⅲ | 向沉淀B中加过量NaOH溶液 | 沉淀全部溶解 |
| Ⅳ | 向Ⅱ得到的滤液中滴加NaOH溶液,调节pH至12 | 生成白色沉淀C |
(2)Ⅱ中生成B反应的离子方程式是
(3)Ⅲ中B溶解反应的离子方程式是
(4)沉淀C的化学式是
(5)若上述n(A):n(B):n(C)=1:2:3,则X的化学式是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:Ⅰ、气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2.X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀;
Ⅱ、根据题给信息知调节pH至5~6时生成的白色沉淀为Al(OH)3.
Ⅲ、加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O.
Ⅳ、加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2.
综上所述:由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:2:3,则CO32-、Al3+、Mg2+的物质的量之比为1:2:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:2:3:10,故X为Mg3Al2(OH)10CO3.
Ⅱ、根据题给信息知调节pH至5~6时生成的白色沉淀为Al(OH)3.
Ⅲ、加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O.
Ⅳ、加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2.
综上所述:由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:2:3,则CO32-、Al3+、Mg2+的物质的量之比为1:2:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:2:3:10,故X为Mg3Al2(OH)10CO3.
解答:
解:(1)气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2,故答案为:CO2;
(2)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3?H20为弱电解质,离子方程式中应写为化学式,离子反应为Al3++3NH3?H20═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H20═Al(OH)3↓+3NH4+;
(3)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2,故答案为:Mg (OH)2;
(5)由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:2:3,则CO32-、Al3+、Mg2+的物质的量之比为1:2:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:2:3:10,故X为Mg3Al2(OH)10CO3.
故答案为:Mg3Al2(OH)10CO3.
(2)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3?H20为弱电解质,离子方程式中应写为化学式,离子反应为Al3++3NH3?H20═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H20═Al(OH)3↓+3NH4+;
(3)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2,故答案为:Mg (OH)2;
(5)由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:2:3,则CO32-、Al3+、Mg2+的物质的量之比为1:2:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:2:3:10,故X为Mg3Al2(OH)10CO3.
故答案为:Mg3Al2(OH)10CO3.
点评:本题考查抗酸药成分的探究实验,题目较为综合,本题易错点为第(5)题,根据质量守恒定律解答.

练习册系列答案
相关题目
关于下列各装置图的叙述中,不正确的是( )
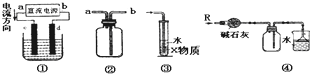

| A、装置①中,c为阳极,d为阴极 |
| B、装置②可用于收集H2、NH3、Cl2、HCl、NO2等 |
| C、装置③中X为苯,可用于吸收氨气或氯化氢 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |