题目内容
为了除去粗盐中含有的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,
(1)下列操作正确的顺序是:
①称取粗盐溶解②加过量Na2CO3③加过量NaOH④加过量BaCl2⑤过滤⑥蒸发、结晶、烘干得到 精盐⑦往滤液中加入适量的盐酸
(2)判断BaCl2已过量的方法是 .
(3)加过量Na2CO3时相关的离子方程式是 .
(4)若先用盐酸调PH再过滤,将对实验结果产生影响,其原因是 .
(1)下列操作正确的顺序是:
①称取粗盐溶解②加过量Na2CO3③加过量NaOH④加过量BaCl2⑤过滤⑥蒸发、结晶、烘干得到 精盐⑦往滤液中加入适量的盐酸
(2)判断BaCl2已过量的方法是
(3)加过量Na2CO3时相关的离子方程式是
(4)若先用盐酸调PH再过滤,将对实验结果产生影响,其原因是
考点:粗盐提纯
专题:实验设计题
分析:(1)首先溶解粗盐,然后选用碳酸钠溶液除去钙离子、除去镁离子、铁离子选用氢氧化钠溶液、除去硫酸根离子选用氯化钡溶液,为了保证将杂质除尽,所加试剂必须过量,为了不引进新的杂质,应该先加入氢氧化钠,然后加入氯化钡,再加入碳酸钠,最后加热盐酸;加入的每种试剂必须过量,保证将所有杂质都能除去,反应完采用加热方法,除去剩余的氯化氢,据此解答本小题即可;
(2)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(3)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子;
(4)Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成氯化镁、氯化钙、氯化钡等物质,会影响制得精盐的纯度.
(2)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(3)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子;
(4)Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成氯化镁、氯化钙、氯化钡等物质,会影响制得精盐的纯度.
解答:
解:(1)粗盐溶解,然后先加入足量的NaOH,除去镁离子、铁离子;然后加入过量BaCl2,除去SO42-、CO32-;再加入过量Na2CO3 除去Ca2+和过量的Ba2+;过滤后,滤液中加入过量的盐酸,除去溶液中剩余的碳酸根和氢氧化钠中的氢氧根,最后加热除去剩余的氯化氢,也可先加BaCl2,再加入NaOH,但应保证,最后依次加入Na2CO3、HCl,故合理顺序是:①③④②⑤⑦⑥或者①④③②⑤⑦⑥,故答案为:①③④②⑤⑦⑥或者①④③②⑤⑦⑥;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第④步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取第④步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(3)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的方程式为:
CaCl2+Na2CO3═CaCO3↓+2NaCl,BaCl2+Na2CO3═BaCO3↓+2NaCl,
反应的实质是:Ca2++CO32-═CaCO3↓;Ba2++CO32-═BaCO3↓,
故答案为:Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓;
(4)若先用盐酸调pH再过滤,那样Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成易溶于水的氯化镁、氯化钙、氯化钡等物质,从而影响氯化钠的纯度,故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度.
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第④步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取第④步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(3)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的方程式为:
CaCl2+Na2CO3═CaCO3↓+2NaCl,BaCl2+Na2CO3═BaCO3↓+2NaCl,
反应的实质是:Ca2++CO32-═CaCO3↓;Ba2++CO32-═BaCO3↓,
故答案为:Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓;
(4)若先用盐酸调pH再过滤,那样Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成易溶于水的氯化镁、氯化钙、氯化钡等物质,从而影响氯化钠的纯度,故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度.
点评:本题考查了粗盐的提纯,是一道物质的分离和提纯的方法和基本操作的综合应用题,充分考查学生的分析、理解能力,难度中等.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
某实验小组只领取下列仪器或用品:铁架台、铁圈、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴.只应用上述仪器或用品,不能进行的实验操作是( )
| A、蒸发 | B、萃取 | C、过滤 | D、蒸馏 |
下列分离和提纯的实验,所选用的方法和仪器不正确的是( )
| 序号 | A | B | C | D |
| 实验目的 | 食盐水与泥沙分离 | 制取蒸馏水 | 分离水和植物油 | 从浓食盐水中 得到氯化钠晶体 |
| 分离方法 | 萃取 | 蒸馏 | 分液 | 蒸发 |
| 选用仪器 |  |  |  |  |
| A、A | B、B | C、C | D、D |
用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后( )
| A、溶液的酸性增强 | ||
B、c(Na+)与c(CO
| ||
| C、溶液浓度变大,有晶体析出 | ||
| D、溶液浓度不变,有晶体析出 |
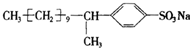 ,其结构中与肥皂(C17H35COONa)的憎水基团-C17H35相当的基团为
,其结构中与肥皂(C17H35COONa)的憎水基团-C17H35相当的基团为
 甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题:
甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题: