题目内容
以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成份为Fe(CrO2)2]为主要原料生产重铬酸钠晶体(Na2Cr2O7?
2H2O)的主要工艺流程如下:
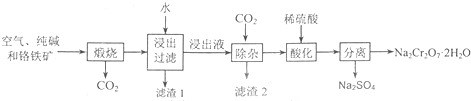
己知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时Al2O3+Na2CO3
2NaAlO2+CO2↑.请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为 .
(2)滤渣1的成分为 ,滤渣2的成分为 .
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是 .
(4)铬铁矿中的Al2O3杂质在工业上可用来冶炼铝,该化学方程式为 .
(5)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol/L以下才能排放.含
CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[KSP(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的
Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准.
②还原法:CrO42-
Cr
Cr(OH)3.写出酸性条件下CrO42-与绿矾在溶液中反应的离子方程式 .
(6)某高效净水剂是由K2FeO4得到的,工业上以溶液W、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是 .
2H2O)的主要工艺流程如下:

己知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时Al2O3+Na2CO3
| ||
. |
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为
(2)滤渣1的成分为
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是
(4)铬铁矿中的Al2O3杂质在工业上可用来冶炼铝,该化学方程式为
(5)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol/L以下才能排放.含
CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[KSP(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的
Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于
②还原法:CrO42-
| 绿矾 |
| H+ |
| 石灰水 |
(6)某高效净水剂是由K2FeO4得到的,工业上以溶液W、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是
考点:制备实验方案的设计,难溶电解质的溶解平衡及沉淀转化的本质,物质分离和提纯的方法和基本操作综合应用
专题:实验题
分析:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3
2NaAlO2+CO2↑,可知主反应为4Fe(CrO2)2+7O2+8Na2CO3
8Na2CrO4+2Fe2O3+8CO2,铬铁矿在空气中与纯碱煅烧生成物通过水浸NaAlO2进入浸出液中,而不溶的Fe2O3形成滤渣1,浸出液通过除杂,通入CO2气体,形成滤渣2Al(OH)3沉淀,最后分离出Na2CrO4溶液,经过酸化、过滤、结晶得到最终产品重铬酸钠晶体( Na2Cr2O7?2H2O).
(1)根据化合物中正负化合价之和为0计算Cr的化合价;
(2)煅烧时铬铁矿的成分之一Fe2O3没有参与反应,也不溶解与水中,铬铁矿煅烧时生成的NaAlO2在水溶液中与CO2生成Al(OH)3沉淀;
(3)Fe2O3与硫酸反应生成Fe3+离子,检验Fe3+离子用KSCN溶液;
(4)电解熔融的Al2O3来冶炼铝,同时生成氧气;
(5)①根据沉淀溶解平衡CrO42-+Ba2+?BaCrO4及Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=1.2×10-10,可得C(Ba2+);
②CrO42-具有氧化性,能把Fe2+氧化成Fe3+,同时自身被还原成Cr3+;
(6)以溶液Fe2(SO4)3、次氯酸钾和氢氧化钾为原料制备K2FeO4,根据原子守恒和得失电子守恒来书写配平方程式.
| ||
| ||
(1)根据化合物中正负化合价之和为0计算Cr的化合价;
(2)煅烧时铬铁矿的成分之一Fe2O3没有参与反应,也不溶解与水中,铬铁矿煅烧时生成的NaAlO2在水溶液中与CO2生成Al(OH)3沉淀;
(3)Fe2O3与硫酸反应生成Fe3+离子,检验Fe3+离子用KSCN溶液;
(4)电解熔融的Al2O3来冶炼铝,同时生成氧气;
(5)①根据沉淀溶解平衡CrO42-+Ba2+?BaCrO4及Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=1.2×10-10,可得C(Ba2+);
②CrO42-具有氧化性,能把Fe2+氧化成Fe3+,同时自身被还原成Cr3+;
(6)以溶液Fe2(SO4)3、次氯酸钾和氢氧化钾为原料制备K2FeO4,根据原子守恒和得失电子守恒来书写配平方程式.
解答:
解:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3
2NaAlO2+CO2↑,可知主反应为4Fe(CrO2)2+7O2+8Na2CO3
8Na2CrO4+2Fe2O3+8CO2,铬铁矿在空气中与纯碱煅烧生成物通过水浸NaAlO2进入浸出液中,而不溶的Fe2O3形成滤渣1,浸出液通过除杂,通入CO2气体,形成滤渣2Al(OH)3沉淀,最后分离出Na2CrO4溶液,经过酸化、过滤、结晶得到最终产品重铬酸钠晶体( Na2Cr2O7?2H2O),
(1)Fe(CrO2)2中,Fe为+2价,+2+2[x+(-2)×2]=0,解得x=+3,故答案为:+3;
(2)煅烧时铬铁矿的成分之一Fe2O3没有参与反应,也不溶解与水中,所以滤渣1的成分为Fe2O3,铬铁矿煅烧时生成的NaAlO2在水溶液中与CO2生成Al(OH)3沉淀,故滤渣2的成分为Al(OH)3,
故答案为:Fe2O3;Al(OH)3;
(3)Fe2O3与硫酸反应生成Fe3+离子,检验该溶液中Fe3+的方法是取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,
故答案为:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,证明有Fe3+;
(4)电解熔融的Al2O3来冶炼铝,其电解方程式为:2 Al2O3(熔融)
4Al+3O2↑;
故答案为:2 Al2O3(熔融)
4Al+3O2↑;
(5)①CrO42-+Ba2+?BaCrO4
5.0×10-7mol?L-1 C(Ba2+)
Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=5.0×10-7×C(Ba2+)=1.2×10-10,C(Ba2+)=2.4×10-4mol/L;
故答案为:2.4×10-4;
②CrO42-具有氧化性,在酸性条件下能把Fe2+氧化成Fe3+,同时自身被还原成Cr3+,反应的离子方程式为CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O,
故答案为:CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O;
(6)以溶液Fe2(SO4)3、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O,
故答案为:Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O.
| ||
| ||
(1)Fe(CrO2)2中,Fe为+2价,+2+2[x+(-2)×2]=0,解得x=+3,故答案为:+3;
(2)煅烧时铬铁矿的成分之一Fe2O3没有参与反应,也不溶解与水中,所以滤渣1的成分为Fe2O3,铬铁矿煅烧时生成的NaAlO2在水溶液中与CO2生成Al(OH)3沉淀,故滤渣2的成分为Al(OH)3,
故答案为:Fe2O3;Al(OH)3;
(3)Fe2O3与硫酸反应生成Fe3+离子,检验该溶液中Fe3+的方法是取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,
故答案为:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,证明有Fe3+;
(4)电解熔融的Al2O3来冶炼铝,其电解方程式为:2 Al2O3(熔融)
| ||
故答案为:2 Al2O3(熔融)
| ||
(5)①CrO42-+Ba2+?BaCrO4
5.0×10-7mol?L-1 C(Ba2+)
Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=5.0×10-7×C(Ba2+)=1.2×10-10,C(Ba2+)=2.4×10-4mol/L;
故答案为:2.4×10-4;
②CrO42-具有氧化性,在酸性条件下能把Fe2+氧化成Fe3+,同时自身被还原成Cr3+,反应的离子方程式为CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O,
故答案为:CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O;
(6)以溶液Fe2(SO4)3、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O,
故答案为:Fe2(SO4)3+3KClO+10KOH=2K2FeO4+3K2SO4+3KCl+5H2O.
点评:本题考查了物质的分离提纯流程,主要考查了操作流程分析、离子检验、金属的冶炼、溶度积常数的计算、方程式的书写等,题目难度中等,侧重于考查学生分析问题和解决问题能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
常见的晶体有如下类型:①分子晶体;②离子晶体;③原子晶体; ④金属晶体.短周期非金属元素所形成的单质或化合物中,固态时的晶体类型可能是( )
| A、①③ | B、①③④ |
| C、①②③ | D、①②④ |
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | ||||||||||
| B、向Cr2O72-+H2O?2CrO42-+2H+的平衡体系中滴加10~20滴6mol/LNaOH溶液颜色由橙色变黄色 | ||||||||||
C、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为 N2(g)+3H2(g)
| ||||||||||
D、已知:
 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 |
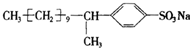 ,其结构中与肥皂(C17H35COONa)的憎水基团-C17H35相当的基团为
,其结构中与肥皂(C17H35COONa)的憎水基团-C17H35相当的基团为