题目内容
17.表示下列反应的离子方程式正确的是( )| A. | 金属钠加入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 铁粉加入到FeCl3溶液中:Fe+2Fe3+═3Fe2+ | |
| C. | 金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO2-+2H2↑ | |
| D. | 铜片插入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
分析 A.反应生成硫酸钠、氢氧化铜、氢气;
B.电子、电荷守恒;
C.电子、电荷不守恒;
D.电子、电荷不守恒.
解答 解:A.金属钠加入到CuSO4溶液中的离子反应为2Na+2H2O+Cu2+═H2↑+Cu(OH)2↓+2Na+,故A错误;
B.铁粉加入到FeCl3溶液中的离子反应为Fe+2Fe3+═3Fe2+,故B正确;
C.金属铝加入到NaOH溶液中的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故C错误;
D.铜片插入到AgNO3溶液中的离子反应为Cu+2Ag+═Cu2++2Ag,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
9.25℃时,在pH=1的溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Ba2+、Mg2+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Na+ |
6.对如图装置(铁的防护)的分析正确的是( )
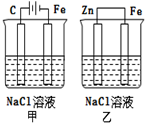

| A. | 甲装置是牺牲阳极的阴极保护法 | |
| B. | 乙装置是牺牲阳极的阴极保护法 | |
| C. | 一段时间后甲、乙装置中pH均增大 | |
| D. | 甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑ |
2.下列化学反应的离子方程式正确的是( )
| A. | 在NaAlO2溶液中通入过量CO2:AlO2-+4CO2+2H2O═Al3++4HCO3- | |
| B. | Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-═CaCO3↓+2HClO | |
| C. | 用Fe(NO3)2溶液加入HCl溶液:Fe2++NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | FeBr2溶液通入少量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
9.用NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 在含有NA 个CH3COO-的醋酸溶液中,H+数目略大于NA | |
| B. | 常温下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.5NA | |
| C. | 16.9 g BaO2固体中阴、阳离子总数为0.3NA | |
| D. | 含有1 mol Fe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
6.可逆反应:2A(g)?3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,下列判断正确的是( )
| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B是固体和C是气体 |
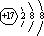 .乙的单质的电子式为
.乙的单质的电子式为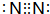 .
.