题目内容
1.用石墨作电极,电解1mol•L-1下列物质的溶液,则电解前后溶液的pH保持不变的是( )| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |
分析 电解时,根据溶液中离子放电顺序判断电解后溶液中氢离子浓度和氢氧根离子浓度的相对大小如何改变,如果电解后溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性,如果氢氧根离子浓度大于氢离子浓度,溶液呈碱性,如果两者相等则溶液呈中性.
解答 解:A、电解硫酸,溶液中氢离子、氢氧根离子放电,所以溶液水量减少,溶液浓度逐渐增大,pH值逐渐变小,故A错误;
B、电解氢氧化钠,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中氢氧化钠的浓度增大,溶液的pH值增大,故B错误;
C、电解硫酸钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中硫酸钠的浓度增大,但溶液中氢离子和氢氧根离子的浓度不变,所以溶液的pH值保持不变,故C正确;
D、电解氯化钠,溶液中氯离子和氢离子放电,所以溶液中氢氧根离子浓度逐渐增大,pH值逐渐变大,故D错误.
故选:C.
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,根据各个电极上放电的离子结合溶液中氢离子或氢氧根离子浓度变化来分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.某主族元素R的最高正化合价与最低负化合价的代数和为4,由此可以判断( )
| A. | R一定有4个电子层 | |
| B. | R原子的最外层电子数一定为6 | |
| C. | R的气态氢化物比电子层数相同的其他非金属元素的气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
9.25℃时,在pH=1的溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、K+、SO42-、Cl- | ||
| C. | Ba2+、Mg2+、SO42-、NO3- | D. | Fe2+、K+、NO3-、Na+ |
16.向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是( )
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
6.对如图装置(铁的防护)的分析正确的是( )
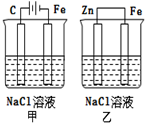

| A. | 甲装置是牺牲阳极的阴极保护法 | |
| B. | 乙装置是牺牲阳极的阴极保护法 | |
| C. | 一段时间后甲、乙装置中pH均增大 | |
| D. | 甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑ |
9.用NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 在含有NA 个CH3COO-的醋酸溶液中,H+数目略大于NA | |
| B. | 常温下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.5NA | |
| C. | 16.9 g BaO2固体中阴、阳离子总数为0.3NA | |
| D. | 含有1 mol Fe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
 D.△H4 = 3/2(△H1 -△H2 - 3△H3)
D.△H4 = 3/2(△H1 -△H2 - 3△H3)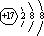 .乙的单质的电子式为
.乙的单质的电子式为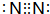 .
. 氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答:
氢氧化钾是重要的工业产品.工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.请回答: