题目内容
3.高碘酸钾(KIO4)为无色晶体,在分析化学中常用作氧化剂.Ⅰ.高碘酸钾的制备
步骤①称取1.270g碘溶于适量的水中,通入足量氯气将I2氧化为高碘酸(HIO4).
步骤②向步骤①所得溶液中加入适量氢氧化钾溶液中和.
步骤③将步骤②所得溶液进行蒸发浓缩、冷却结晶等操作得KIO4晶体.
(1)步骤①将I2氧化为HIO4,至少需要消耗0.784L(标准状况)Cl2.
(2)步骤①所得溶液用0.200mol•L-1KOH溶液中和至中性时(HIO4为强酸,假定溶液中不含Cl2和HClO),则消耗0.200mol•L-1KOH溶液的体积为400mL.
Ⅱ.用高碘酸钾测定甘油的含量
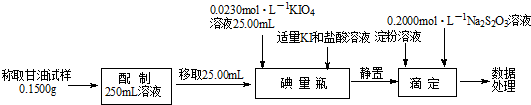
相关反应:C3H8O3(甘油)+2HIO4=2HCHO+HCOOH+2HIO3+H2O
HIO3+5KI+5HCl=3I2+5KCl+3H2O
HIO4+7KI+7HCl=4I2+7KCl+4H2O
I2+2Na2S2O3=2NaI+Na2S4O6
(3)用0.2000mol•L-1Na2S2O3标准溶液滴定时,判断达到滴定终点的现象是滴入最后一滴标准液时,溶液蓝色刚好褪去,且保持30秒不恢复原来的颜色.
(4)已知滴定至终点时消耗Na2S2O3溶液20.00mL,计算甘油样品的纯度(请给出计算过程).
分析 Ⅰ.(1)根据电子得失守恒可知,将I2氧化为HIO4时,有关系式I2~7Cl2,根据碘的质量可计算出氯气的量;
(2)根据碘元素守恒可知,1.270g I2氧化为高碘酸时,HIO4的物质的量为$\frac{1.270g}{254g/mol}$=0.005mol,同时生成氯化氢的物质的量为0.07mol,与氢氧化钾反应的关系式为7HCl~HIO4~KOH,据此计算氢氧化钾溶液的体积;
Ⅱ.(3)碘溶液中有淀粉,所以溶液呈蓝色,用Na2S2O3标准溶液滴定达到滴定终点时溶液的蓝色会褪去,据此判断;
(4)根据题中的反应方程式可得关系式C3H8O3~$\frac{1}{2}$HIO3,I2~2Na2S2O3,3n(HIO3)+4n(HIO4)=n(I2),
碘量瓶中n(HIO3)+n(HIO4)=n(KIO4)=0.0230 mol•L×25.00mL×10-3 L•mL=5.750×10-4 mol…①
滴定时:3n(HIO3)+4n(HIO4)=n(I2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.2000 mol•L×20.00mL×10-3 L•mL-1=2.000×10-3 mol…②
根据①②可求得与C3H8O3反应的HIO3,根据HIO3的物质的量可计算出甘油的质量,进而确定样品的纯度.
解答 解:Ⅰ.(1)根据电子得失守恒可知,将I2氧化为HIO4时,有关系式I2~7Cl2,1.270g 碘的质量为$\frac{1.270g}{254g/mol}$=0.005mol,所以消耗的氯气的物质的量为0.035mol,其体积为0.035mol×22.4L/mol=0.784L,
故答案为:0.784;
(2)根据碘元素守恒可知,1.270g I2氧化为高碘酸时,HIO4的物质的量为$\frac{1.270g}{254g/mol}$×2=0.01mol,同时生成氯化氢的物质的量为0.07mol,与氢氧化钾反应的关系式为7HCl~HIO4~KOH,所以V(KOH)=$\frac{0.01mol}{0.200mol/L}$×8=0.05L×8=400mL,
故答案为:400;
Ⅱ.(3)碘溶液中有淀粉,所以溶液呈蓝色,所以用Na2S2O3标准溶液滴定,判断达到滴定终点的现象是滴入最后一滴标准液时,溶液蓝色刚好褪去,且保持30秒不恢复原来的颜色,
故答案为:滴入最后一滴标准液时,溶液蓝色刚好褪去,且保持30秒不恢复原来的颜色;
(4)根据题中的反应方程式可得关系式C3H8O3~$\frac{1}{2}$HIO3,I2~2Na2S2O3,3n(HIO3)+4n(HIO4)=n(I2),
碘量瓶中n(HIO3)+n(HIO4)=n(KIO4)=0.0230 mol•L×25.00mL×10-3 L•mL=5.750×10-4 mol…①
滴定时:3n(HIO3)+4n(HIO4)=n(I2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.2000 mol•L×20.00mL×10-3 L•mL-1=2.000×10-3 mol…②
①×4-②得 n(HIO3)=3.000×10-4 mol
n(C3H8O3)=$\frac{1}{2}$n(HIO3)=1.500×10-4 mol
w(C3H8O3)=$\frac{1.5×1{0}^{-4}×92×10}{0.150}$×100%=92.00%,
答:甘油样品的纯度为92.00%.
点评 本题以高碘酸钾的制备以及测定甘油的含量为载体,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,内容涉及方程式计算、氧化还原滴定、实验基本操作等,难度中等,是对知识的综合运用和能力的考查,难点是(4)中确定各个物理量的关系式.

 乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
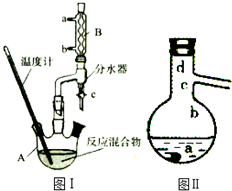
乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:Ⅰ.将混合液(18.5mL正丁醇和13.4mL乙酸(过量),0.4mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟.
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤.
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1g乙酸正丁酯.
部分实验数据如表所示:
| 化合物 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 溶解度(g)/(100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 乙酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 1 1 6 | 0.882 | 126.1 | 0.7 |
(2)步骤Ⅱ中的操作顺序为①③①②(填序号),用Na2CO3溶液洗涤的目的是除去残留在产品中的酸,试剂X不能选用下列物质中的b(填字母序号).
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示).
①蒸馏过程中需要使用直形冷凝管,当仪器连接好后,
a.向相应的冷凝管中通冷凝水;
b.加热蒸馏烧瓶的先后顺序是先a后b.(填“先a后b“或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的a、b(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质.
(4)该实验乙酸正丁酯的产率是74%(计算结果保留2位有效数字).
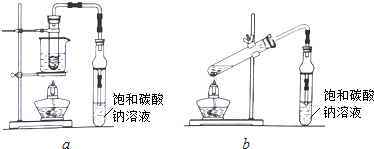
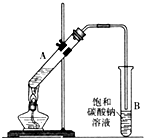 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.有关数据及副反应:| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
C2H5OH+C2H5OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O
请回答下列问题:
(1)在大试管A中添加的试剂有6mL乙醇、4mL乙酸和4mL浓硫酸,这三种试剂的添加顺序依次为乙醇、浓硫酸、乙酸
(2)试管B中导管接近液面未伸入液面下的理由是防止发生倒吸
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是:
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77.1℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生大量的酸性废液污染环境,有副反应发生
(5)炒菜时,加一点白酒和醋能使菜肴昧香可口,试用符合实际情况的化学方程式解释:CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
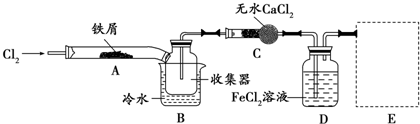
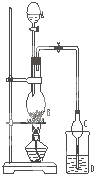 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH ②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)该小组同学在实验时才取了加入过量的乙醇,目的是增加乙醇的用量提高乙酸的转化率和提高产率,同时慢慢滴加乙酸并加热蒸馏,蒸馏的目的是蒸馏出乙酸乙酯,减小生成物,反应正向移动,提高产率 .
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇和水;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol (燃烧热) | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反应热) | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
| A. | 3△H1+2△H2-△H3 | B. | △H1+△H2-△H3 | C. | 3△H1+△H2+△H3 | D. | 3△H1+△H2-△H3 |
| A. | 8.4 L | B. | 11.2 L | C. | 14.0 L | D. | 16.8 L |