题目内容
某同学利用如图1装置进行实验,最初天平保持平衡状态.

(1)写出天平左边的烧杯中发生反应的离子方程式: .
(2)写出右边铜片上发生的电极反应式: .
(3)左边烧杯中产生气体的体积(在标准状况下)与时间的关系如图所2示.则在下图中用虚线画出右边烧杯产生气体体积(标准状况下)与时间的关系曲线.
(4)从反应开始至结束,天平的平衡状态为 .

(1)写出天平左边的烧杯中发生反应的离子方程式:
(2)写出右边铜片上发生的电极反应式:
(3)左边烧杯中产生气体的体积(在标准状况下)与时间的关系如图所2示.则在下图中用虚线画出右边烧杯产生气体体积(标准状况下)与时间的关系曲线.
(4)从反应开始至结束,天平的平衡状态为
考点:原电池和电解池的工作原理,离子方程式的书写,电极反应和电池反应方程式
专题:
分析:(1)铜的活泼性位于H之后,不与稀硫酸反应,铁与稀硫酸反应生成氢气和硫酸亚铁,据此写出离子反应方程式即可;
(2)右边烧杯中铜片与铁片用导线连接,与稀硫酸溶液构成原电池,铁作原电池的负极,铜作正极,据此解答即可;
(3)由于右边烧杯构成原电池,故加快了化学反应速率,但是由于铁片的质量以及稀硫酸的物质的量均不变,故生成氢气总量相等,据此画图即可;
(4)右边化学反应速率快,即初始阶段放出氢气的速率快,故质量减轻的多,最后放出氢气质量一样,据此解答即可.
(2)右边烧杯中铜片与铁片用导线连接,与稀硫酸溶液构成原电池,铁作原电池的负极,铜作正极,据此解答即可;
(3)由于右边烧杯构成原电池,故加快了化学反应速率,但是由于铁片的质量以及稀硫酸的物质的量均不变,故生成氢气总量相等,据此画图即可;
(4)右边化学反应速率快,即初始阶段放出氢气的速率快,故质量减轻的多,最后放出氢气质量一样,据此解答即可.
解答:
解:(1)铁与稀硫酸反应生成氢气和硫酸亚铁,离子反应方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)铜片与铁片用导线连接,与稀硫酸溶液构成原电池,铁作原电池的负极,铜作正极,溶液中的氢离子在铜电极上得到电子生成氢气,电极反应方程式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)右边烧杯构成原电池,故加快了化学反应速率,但是由于铁片的质量以及稀硫酸的物质的量均不变,故生成氢气总量相等,图象如下: ,故答案为:
,故答案为: ;
;
(4)右边化学反应速率快,即初始阶段放出氢气的速率快,故质量减轻的多,最后放出氢气质量一样,故天平状态为:反应过程中,起初天平左边托盘低,右边托盘高,最后天平保持平衡,故答案为:反应过程中,起初天平左边托盘低,右边托盘高,最后天平保持平衡.
(2)铜片与铁片用导线连接,与稀硫酸溶液构成原电池,铁作原电池的负极,铜作正极,溶液中的氢离子在铜电极上得到电子生成氢气,电极反应方程式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(3)右边烧杯构成原电池,故加快了化学反应速率,但是由于铁片的质量以及稀硫酸的物质的量均不变,故生成氢气总量相等,图象如下:
 ,故答案为:
,故答案为: ;
;(4)右边化学反应速率快,即初始阶段放出氢气的速率快,故质量减轻的多,最后放出氢气质量一样,故天平状态为:反应过程中,起初天平左边托盘低,右边托盘高,最后天平保持平衡,故答案为:反应过程中,起初天平左边托盘低,右边托盘高,最后天平保持平衡.
点评:本题考查原电池原理,明确发生的电极反应及图象的分析是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
下列物质中属于电解质的是( )
| A、Cu |
| B、蔗糖 |
| C、Na2CO3 |
| D、乙醇 |
用惰性电极在U形管中电解下列物质的水溶液,消耗相同的电量时,U形管中有固体析出时在相同条件下收集的气体体积最大是( )
| A、AlCl3溶液 |
| B、AgNO3溶液 |
| C、Na2SO4溶液 |
| D、NaOH溶液 |
有关Na2CO3和NaHCO3的叙述中正确的是( )
| A、区别NaHCO3与Na2CO3溶液,Ca(OH)2溶液和CaCl2溶液均可用 |
| B、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| C、NaHCO3的溶解度比Na2CO3的大 |
| D、Na2CO3固体中混有NaHCO3,高温灼烧即可 |
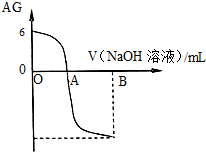 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol/L的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)+c(H+)=c(OH-) |
在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的( )
A、 |
B、 |
C、 |
D、 |
已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:甲
乙
丙;下列说法不正确的是( )
| 试剂A |
| 试剂A |
| A、若乙为NaHC03,则丙一定是C02 |
| B、若A为氯水,X为金属元素,则甲与丙反应可生成乙 |
| C、若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 |
| D、若甲为单质硫,则丙溶于水形成的浓溶液能与碳反应可生成乙 |



