题目内容
 已知A为淡黄色固体,E、D为两种常见的用途很广的金属单质,H的溶液中含有两种金属阳离子,I不溶于水.
已知A为淡黄色固体,E、D为两种常见的用途很广的金属单质,H的溶液中含有两种金属阳离子,I不溶于水.(1)写出下列物质的化学式:
A:
(2)E是活泼金属,但在空气中却能稳定存在,E在空气中能稳定存在的原因是:
(3)按要求写方程式:
A与水反应的化学方程式:
B与E反应的离子方程式:
考点:无机物的推断
专题:
分析:A为淡黄色固体,能和水反应,则A是Na2O2,过氧化钠和水反应生成NaOH和氧气,E、D为两种常见的用途很广的金属单质,其中一种能与氢氧化钠溶液反应,则该金属为Al,另外金属与氧气反应得到金属氧化物,故G、F分别为偏铝酸钠、金属氧化物,由于G能与二氧化碳反应,F与盐酸反应生成的H中含有两种金属阳离子,则E为Al,B为NaOH,G为NaAlO2,I不溶于水,则I是Al(OH)3,F为金属氧化物,D是Fe,F是Fe3O4,H是FeCl2、FeCl3,据此解答.
解答:
解:A为淡黄色固体,能和水反应,则A是Na2O2,过氧化钠和水反应生成NaOH和氧气,E、D为两种常见的用途很广的金属单质,其中一种能与氢氧化钠溶液反应,则该金属为Al,另外金属与氧气反应得到金属氧化物,故G、F分别为偏铝酸钠、金属氧化物,由于G能与二氧化碳反应,F与盐酸反应生成的H中含有两种金属阳离子,则E为Al,B为NaOH,G为NaAlO2,I不溶于水,则I是Al(OH)3,F为金属氧化物,D是Fe,F是Fe3O4,H是FeCl2、FeCl3,
(1)由上述分析可知,A为Na2O2,F为Fe3O4,I为Al(OH)3,故答案为:Na2O2;Fe3O4;Al(OH)3;
(2)E为Al,在空气中铝表面形成致密氧化膜,阻止铝继续氧化,在空气中能稳定存在,故答案为:铝表面形成致密氧化膜,阻止铝继续氧化;
(3)A与水反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
B与E反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑.
(1)由上述分析可知,A为Na2O2,F为Fe3O4,I为Al(OH)3,故答案为:Na2O2;Fe3O4;Al(OH)3;
(2)E为Al,在空气中铝表面形成致密氧化膜,阻止铝继续氧化,在空气中能稳定存在,故答案为:铝表面形成致密氧化膜,阻止铝继续氧化;
(3)A与水反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
B与E反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评:本题考查无机物推断,涉及Na、Al、Fe元素化合物性质,注意根据“A的颜色且与水发生反应、H的溶液中含有两种金属阳离子”推断,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
相关题目
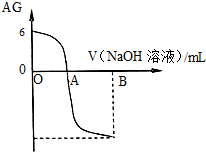 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol/L的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)+c(H+)=c(OH-) |
已知如下两个热化学反应方程式:下列说法错误的是( )
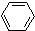 (1)+H2(g)→
(1)+H2(g)→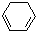 (1)-Q ①
(1)-Q ①
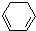 (1)+2H2(g)→
(1)+2H2(g)→ (1)+Q ②
(1)+Q ②
 (1)+H2(g)→
(1)+H2(g)→ (1)-Q ①
(1)-Q ① (1)+2H2(g)→
(1)+2H2(g)→ (1)+Q ②
(1)+Q ②| A、反应①、②都属于加成反应 |
| B、1,3-环己二烯比苯稳定 |
| C、反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D、反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
下列提纯物质的实验方法不正确的是( )
①用Na2CO3溶液除去混在NaCl溶液中的MgCl2杂质
②用蒸馏法除去混在水中的氧气
③用酒精萃取溶解在水中的溴
④将KMnO4溶液减压低温蒸发,以获得晶体KMnO4.
①用Na2CO3溶液除去混在NaCl溶液中的MgCl2杂质
②用蒸馏法除去混在水中的氧气
③用酒精萃取溶解在水中的溴
④将KMnO4溶液减压低温蒸发,以获得晶体KMnO4.
| A、② | B、③④ |
| C、①②③ | D、①②③④ |
向一定量的Cu、Fe203的混合物中加人600mL 2mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,再加入过量1mol/L NaOH溶液,将沉淀过滤、洗涤、干燥,称得质量比原混合物增重17.6g,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量是( )
| A、4.8 g |
| B、8.8 g |
| C、9.6g |
| D、14.4g |
已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:甲
乙
丙;下列说法不正确的是( )
| 试剂A |
| 试剂A |
| A、若乙为NaHC03,则丙一定是C02 |
| B、若A为氯水,X为金属元素,则甲与丙反应可生成乙 |
| C、若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 |
| D、若甲为单质硫,则丙溶于水形成的浓溶液能与碳反应可生成乙 |
铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g.下列说法正确的是( )
| A、剩余固体是铁、铜混合物 |
| B、原固体混合物中铜的质量是9.6g |
| C、反应后溶液中n(Fe3+)=0.10 mol |
| D、反应后溶液中n(Fe2+)+n(Cu2+)=0.75 mol |
常温下,pH=a的FeCl3溶液和pH=b的K2CO3溶液中,由水电离的c(H+)相同,则a和b的关系是( )
| A、a=b | B、a>b |
| C、a+b=14 | D、a<14-b |
化学雕刻法是指用化学药品在一些固体材料表面腐蚀出图案的方法.对以下材料进行化学雕刻,所用药品错误的是( )
| A、用氢氟酸雕刻玻璃 |
| B、用浓硝酸雕刻水晶 |
| C、用三氯化铁溶液雕刻铜板 |
| D、用盐酸雕刻汉白玉 |