题目内容
碘元素的单质和化合物在现实生产生活中应用广泛.(提示:问题(2)更简单一些)
(1)碘化钾(KI)是常用的还原剂.某研究性学习小组利用碘酸钾(KIO3)测定碘化钾的浓度.在10.00mL的KI溶液中逐滴滴入用硫酸酸化的KIO3溶液,溶液颜色不再变化后,用Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),消耗0.2000mol?L-1Na2S2O3溶液30.00mL.
滴定过程发生的离子方程式如下:2S2O32-+I2═S4O62-+2I-
①写出本实验中碘酸钾和碘化钾反应的化学方程式(提示:硫酸也参与反应)
②Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),滴定终点如何判断:
③测定的KI溶液浓度是 mol?L-1
(2)探究酸性KIO3溶液的与KI溶液反应中KIO3浓度和温度对反应速率的影响,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.
某同学设计实验如下表所示:
①由小到大比较t1、t2、t3的大小 ;表中V1= mL;
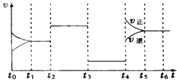
②用Na2S2O3标准溶液滴定生成的I2,应该选用 式滴定管.滴定前排气泡时,应选用下图中的 .

(1)碘化钾(KI)是常用的还原剂.某研究性学习小组利用碘酸钾(KIO3)测定碘化钾的浓度.在10.00mL的KI溶液中逐滴滴入用硫酸酸化的KIO3溶液,溶液颜色不再变化后,用Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),消耗0.2000mol?L-1Na2S2O3溶液30.00mL.
滴定过程发生的离子方程式如下:2S2O32-+I2═S4O62-+2I-
①写出本实验中碘酸钾和碘化钾反应的化学方程式(提示:硫酸也参与反应)
②Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),滴定终点如何判断:
③测定的KI溶液浓度是
(2)探究酸性KIO3溶液的与KI溶液反应中KIO3浓度和温度对反应速率的影响,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.
某同学设计实验如下表所示:
| 0.01mol?L-1KIO3酸性溶液的体积/mL | 0.01mol?L-1KI溶液的体积/mL | H2O的体积 /mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | 5 | 5 | 25 | t1 |
| 实验2 | 4 | 5 | V1 | 25 | t2 |
| 实验3 | 5 | 5 | 5 | 35 | t3 |
②用Na2S2O3标准溶液滴定生成的I2,应该选用

考点:探究物质的组成或测量物质的含量,氯、溴、碘及其化合物的综合应用
专题:实验探究和数据处理题
分析:(1)①根据题干信息可知,碘化钾与碘酸钾在酸性条件下反应生成碘单质,据此写出反应的化学方程式;
②反应结束前溶液为蓝色,反应结束后溶液变成无色,据此判断滴定终点;
③根据反应方程式找出碘化钾与硫代硫酸根离子的关系式,然后根据硫代硫酸根离子的物质的量计算出碘化钾的物质的量,再根据c=
计算出该碘化钾的物质的量浓度;
(2)①温度对反应速率影响最大,其次浓度越大,反应速率越快,据此判断t1、t2、t3的大小;实验过程中溶液总体积必须完全相同,据此判断V1;
②硫代硫酸镁溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡.
②反应结束前溶液为蓝色,反应结束后溶液变成无色,据此判断滴定终点;
③根据反应方程式找出碘化钾与硫代硫酸根离子的关系式,然后根据硫代硫酸根离子的物质的量计算出碘化钾的物质的量,再根据c=
| n |
| V |
(2)①温度对反应速率影响最大,其次浓度越大,反应速率越快,据此判断t1、t2、t3的大小;实验过程中溶液总体积必须完全相同,据此判断V1;
②硫代硫酸镁溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡.
解答:
解:(1)①本实验中碘酸钾和碘化钾、稀硫酸反应生成碘单质、硫酸钾和水,反应的化学方程式为:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4 ,
故答案为:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4 ;
②用Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),反应结束前溶液为蓝色,当反应结束时碘单质消失,溶液变成无色,则滴定终点为:当滴加最后一滴Na2S2O3溶液,溶液恰好由蓝色变为无色且半分钟内不变色即为滴定终点,
故答案为:当滴加最后一滴Na2S2O3溶液,溶液恰好由蓝色变为无色且半分钟内不变色即为滴定终点;
③0.2000mol?L-1Na2S2O3溶液30.00mL中含有硫代硫酸钠的物质的量为:0.2000mol/L×0.03L=0.006mol,
根据反应2S2O32-+I2═S4O62-+2I-、KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4 可得关系式:5KI~3I2~6S2O32-,则消耗0.006mol硫代硫酸根离子时,参加反应的碘化钾的物质的量为:0.006mol×
=0.005mol,
所以该碘化钾溶液的浓度为:
=0.5000mol/L,
故答案为:0.5000;
(2)实验3中反应温度最高,该反应速率最快,则反应时间t3最小,实验1和实验2的温度相同,由于实验1中碘酸钾溶液浓度大于实验2,实验1的反应速率大于实验2,则实验1的反应时间小于实验2,所以反应时间大小为:t3<t1<t2;
对比实验中溶液总体积必须相等,结合实验1、3可知,混合液总体积为:5mL×3=15mL,则V1=15mL-5mL-4mL=6mL,
故答案为:t3<t1<t2;6;
②Na2S2O3溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法为:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;
故答案为:碱;③.
故答案为:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4 ;
②用Na2S2O3溶液滴定生成的I2(使用淀粉做指示剂),反应结束前溶液为蓝色,当反应结束时碘单质消失,溶液变成无色,则滴定终点为:当滴加最后一滴Na2S2O3溶液,溶液恰好由蓝色变为无色且半分钟内不变色即为滴定终点,
故答案为:当滴加最后一滴Na2S2O3溶液,溶液恰好由蓝色变为无色且半分钟内不变色即为滴定终点;
③0.2000mol?L-1Na2S2O3溶液30.00mL中含有硫代硫酸钠的物质的量为:0.2000mol/L×0.03L=0.006mol,
根据反应2S2O32-+I2═S4O62-+2I-、KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4 可得关系式:5KI~3I2~6S2O32-,则消耗0.006mol硫代硫酸根离子时,参加反应的碘化钾的物质的量为:0.006mol×
| 5 |
| 6 |
所以该碘化钾溶液的浓度为:
| 0.005mol |
| 0.01L |
故答案为:0.5000;
(2)实验3中反应温度最高,该反应速率最快,则反应时间t3最小,实验1和实验2的温度相同,由于实验1中碘酸钾溶液浓度大于实验2,实验1的反应速率大于实验2,则实验1的反应时间小于实验2,所以反应时间大小为:t3<t1<t2;
对比实验中溶液总体积必须相等,结合实验1、3可知,混合液总体积为:5mL×3=15mL,则V1=15mL-5mL-4mL=6mL,
故答案为:t3<t1<t2;6;
②Na2S2O3溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法为:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;
故答案为:碱;③.
点评:本题考查了探究物质组成的方法、影响化学反应速率的因素及其应用,题目难度中等,明确探究原理为解答关键,注意明确关系式法在化学计算中的应用,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
下列有关元素的性质及其递变规律正确的是( )
| A、同主族元素形成的单质熔沸点自上而下逐渐升高 |
| B、核外电子排布相同的微粒化学性质不一定相同 |
| C、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| D、非金属元素的气态氢化物的稳定性越强其沸点就越高 |
埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是( )
| A、在潮湿疏松的碱性土壤中 |
| B、在含铁元素较多的酸性土壤中 |
| C、在干燥致密不透气的土壤中 |
| D、在含碳粒较多,潮湿透气的中性土壤中 |


 的相对分子质量大2,则符合下列条件的G的同分异构体有
的相对分子质量大2,则符合下列条件的G的同分异构体有

 +R′-Cl→
+R′-Cl→ +HCl
+HCl


 (1)已知下列反应:
(1)已知下列反应: