题目内容
20.下列说法正确的是( )| A. | 可逆返应达到平衡的重要特征是正、逆反应速率都为零,反应停止了 | |
| B. | 在可逆反应里,正反应的速率是正值,逆反应的速率是负值 | |
| C. | 对于H2+I2 2HI,当有1molH-H键断裂的同时,有2molH-I键生成,说明此可逆反应已达化学平衡 2HI,当有1molH-H键断裂的同时,有2molH-I键生成,说明此可逆反应已达化学平衡 | |
| D. | 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,表明该反应达到化学平衡状态 |
分析 A.可逆反应达到平衡的重要特征是正、逆反应速率相等但不为零;
B.在可逆反应里正反应的速率、逆反应的速率都取正值;
C.当有1molH-H键断裂的同时,有2molH-I键生成都是指正反应方向;
D.根据化学反应限度的概念判断.
解答 解:A.可逆反应达到平衡为动态平衡,其重要特征是正、逆反应速率相等但不为零,故A错误;
B.在可逆反应里正反应的速率、逆反应的速率都取正值,只有单位,没有正负,故B错误;
C.当有1molH-H键断裂的同时,有2molH-I键生成都是指正反应方向,所以不能说明此可逆反应已达化学平衡,故C错误;
D.达到化学反应限度时,正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,达到平衡状态,故D正确.
故选D.
点评 本题主要考查了化学反应速率和限度,为高频考点,侧重于学生的分析能力的考查,注意相关概念的理解,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.X、Y 为两种不同元素,由它们组成的下列物质的分子中,肯定有极性的是( )
| A. | XY | B. | XY3 | C. | XY2 | D. | XY4 |
8. 某化学小组构想将汽车尾气(NO、NO2)转化为重要要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
 某化学小组构想将汽车尾气(NO、NO2)转化为重要要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )
某化学小组构想将汽车尾气(NO、NO2)转化为重要要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料.下列说法一定正确的是( )| A. | 该电池工作时,外电路电子的流向由A到B,内电路由B到A形成闭合回路 | |
| B. | 电极 B 附近的 c(H+)浓度增大 | |
| C. | A 电极的反应为:NO2-e-+H2O=NO3-+2H+ NO-3e-+2H2O=NO3-+4H+ | |
| D. | 该电池工作时,每消耗11.2LO2(标年状况下)可以除去含1molNO和NO2的混合尾气 |
15.下列物质中,不能使酸性高锰酸钾溶液褪色的是( )
| A. | 苯乙烯 | B. | 乙烯 | C. | 乙醇 | D. | 聚乙烯 |
12.己知:镁电池的总反应为xMg+Mo3S4 $?_{充电}^{放电}$MgxMo3S4,某车载锂离子电池的总反应为:Li1-xCoO2+LixC6 $?_{充电}^{放电}$LiCoC2+C6(x<1).下列说法正确的是( )
| A. | 镁电池放电时,Mg2+向负极移动 | |
| B. | 镁电池充电时,阳极发生的反应为:Mo3S42x--2xe-=Mo3S4 | |
| C. | 锂离子电池放电时,负极的电极反应式为 LixC6+xe-=xLi++C6 | |
| D. |  用镁电池给车载锂离子电池充电时连接方式如图所示 |
9.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验目的或结论 |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 欲确定磷、砷两元素非金属性的强弱 | 测定同温同浓度的Na3PO4和Na3AsO4水溶液的pH |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| A. | A | B. | B | C. | C | D. | D |

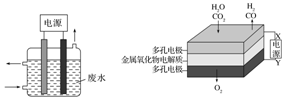 用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;
用图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O;