题目内容
7.某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.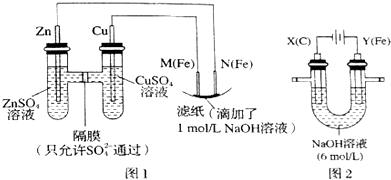
请回答:
Ⅰ.用如图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是A(填字母序号).
A.铝.B.石墨 C.银 D.铂
(2)M极发生反应的电极反应式为Fe-2e-+2OH-=Fe(OH)2;
(3)实验过程中,SO42-从右向左(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有滤纸上有红褐色斑点产生,写出产生此现象的反应方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
Ⅱ.用如图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH增大(填“增大”、“减小”或“不变”);
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-═FeO42-+4H2O 和 4OH--4e-═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少0.28g.
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极的电极反应式为2FeO42-+6e-+5H2O═Fe2O3+10OH-.
分析 Ⅰ图1中,左边装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,如果要找电极材料代替铜,所找材料必须是不如锌活泼的金属或导电的非金属,M是阳极,N是阴极,电解池中阴极上阳离子得电子发生还原反应,原电池放电时,阴离子向负极移动;
Ⅱ该电解池中,阳极材料是活泼金属,则电解池工作时,阳极上铁失电子发生氧化反应,同时氢氧根离子失电子生成氧气,阴极上氢离子得电子发生还原反应,根据阴阳极上转移电子数相等计算铁反应的质量,在碱性锌电池中,正极上得电子发生还原反应,以此解答该题.
解答 解:Ⅰ、(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,
故选A;
(2)M为阳极,发生氧化反应,电极反应式为Fe-2e-+2OH-=Fe(OH)2,故答案为:Fe-2e-+2OH-=Fe(OH)2;
(3)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动,电解池中,阴极上氢离子得电子生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,所以滤纸上有红褐色斑点产生,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:从右向左;滤纸上有红褐色斑点产生;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
Ⅱ、(4)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的pH增大,故答案为:增大;
(5)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得$\frac{0.672L}{22.4L/mol}$×2=$\frac{0.168L}{22.4L/mol}$×4+
$\frac{xg}{56g/mol}$×6,解得x=0.28g,故答案为:0.28;
(6)正极上高铁酸根离子得电子发生还原反应,反应方程式为2FeO42-+6e-+5H2O═Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O═Fe2O3+10OH-.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力的考查,注意电解池中如果活泼金属作阳极,则电解池工作时阳极材料失电子发生氧化反应,为易错点,难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 镁粉(铝粉):加入过量烧碱溶液,过滤 | |
| B. | FeCl3溶液(FeCl2):加入适量的稀硝酸 | |
| C. | CuO(Al2O3):加入过量烧碱溶液,过滤 | |
| D. | CO2(HCl):通过饱和碳酸氢钠溶液,洗气 |
| A. | 乙醇和乙酸分子都能和金属钠反应 | |
| B. | 乙酸能溶于水,但不溶于乙醇 | |
| C. | 乙醇和乙酸均能使紫色石蕊试液变红 | |
| D. | 乙醇和乙酸互为同分异构体 |
 保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.
保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段.①氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和-COOH(写结构简式).
②发育出现障碍,患营养缺乏症,这主要是由于摄取蛋白质(填“蛋白质”“脂肪”或“糖类”)不足引起的.下列食物中富含该物质的是C(填字母).
A.菠菜B.花生油 C.瘦肉D.西瓜
③如图所示4支试管同时水浴加热4min,为检验其中淀粉的水解程度,某同学的实验操作与现象记录如下:
| 编号 | 操作 | 现象 |
| 1 | 加入碘水 | 溶液变成蓝色 |
| 2 | 加入银氨溶液,水浴加热 | 未出现银镜 |
| 3 | 加入碘水 | 溶液变成蓝色 |
| 4 | 加入银氨溶液,水浴加热 | 未出现银镜 |
| A. | NaHCO3═CO32-+H++Na+ | B. | S2-+H2O?H2S+2 OH- | ||
| C. | H3PO4?3H++PO43- | D. | NH3•H2O?NH4++OH- |
| A. | ①戊烷②丙烷③丁烷沸点高低顺序为①>③>② | |
| B. | CH4与Cl2以体积比1:4混合,光照时可制得纯净的CCl4 | |
| C. | 苯能在一定条件下跟H2加成生成环己烷 | |
| D. | CH2=CH2+H2O→CH3-CH2OH 是加成反应 |
| A. |  实验室中制取少量蒸馏水 | B. |  分离碘和酒精 | ||
| C. |  称量氢氧化钠固体 | D. |  配制100 mL 0.10 mol•L-1盐酸 |
 .
.