题目内容
9.(1)NaHCO3溶液中存在多种平衡关系,写出相应平衡关系所对应的离子方程式:H2O H++OH-、HCO3-+H2O
H++OH-、HCO3-+H2O +H2CO3+OH-、HCO3-+H2O
+H2CO3+OH-、HCO3-+H2O H3O++CO32-
H3O++CO32- NaHCO3溶液显碱性的原因:NaHCO3溶液中HCO3-的水解程度大于电离程度,使得溶液中c(OH-)大于c(H+)而显碱性.
NaHSO4溶液显酸性的原因:NaHSO4溶液中NaHSO4完全电离成Na+、H+、SO42-,使得溶液中c(H+)大于c(OH-)而显碱性.
(2)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O.放出571.6kJ的热量,表示H2燃烧热的热化学方程式为H2(g)+0.5O2(g)=H2O(l)△H=-285.8kJ/mol.
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为0.5H2SO4(aq)+NaOH(aq)=0.5Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(4)已知C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
C(s)+0.5O2(g)=CO(g)△H3=akJ/mol,则a=-110.5
(5)已知N2(g)+3H2(g)?2NH3(g)的平衡常数为K1,0.5N2(g)+1.5H2(g)?NH3(g) 的平衡常数为K2,NH3(g)?0.5N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式K1=K22,写出K2和K3的关系式K2•K3=1,写出K1和K3的关系式K1•K32=1.
分析 (1)NaHCO3溶液存在水的电离平衡、弱酸根离子的水解平衡、电离平衡;
NaHCO3溶液水解碱性;
NaHSO4溶液电离显酸性;
(2)H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,可知1molH2在0.5molO2中完全燃烧生成1.00mol液态H2O,放出285.8kJ的热量;
(3)生成2molH2O,放出114.6kJ的热量,则中和反应生成1molH2O,放出57.3kJ的热量;
(4)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol,
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
由盖斯定律可知,①-②×0.5可得C(s)+0.5O2(g)=CO(g);
(5)化学计量数为倍数关系,则K为指数关系,互为相反的两个反应的K互为倒数关系,以此来解答.
解答 解:(1)NaHCO3溶液中存在H2O


故答案为:H2O


(2)H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,可知1molH2在0.5molO2中完全燃烧生成1.00mol液态H2O,放出285.8kJ的热量,则表示H2燃烧热的热化学方程式为H2(g)+0.5O2(g)=H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+0.5O2(g)=H2O(l)△H=-285.8kJ/mol;
(3)生成2molH2O,放出114.6kJ的热量,则中和反应生成1molH2O,放出57.3kJ的热量,则表示其中和热的热化学方程式为0.5H2SO4(aq)+NaOH(aq)=0.5Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:0.5H2SO4(aq)+NaOH(aq)=0.5Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(4)①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol,
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
由盖斯定律可知,①-②×0.5可得C(s)+0.5O2(g)=CO(g),则a=(-393.5)-(-566.0)×0.5=-110.5,
故答案为:-110.5;
(5)由N2(g)+3H2(g)?2NH3(g)的平衡常数为K1,0.5N2(g)+1.5H2(g)?NH3(g) 的平衡常数为K2,K1和K2的关系式为K1=K22;
由0.5N2(g)+1.5H2(g)?NH3(g) 的平衡常数为K2、NH3(g)?0.5N2(g)+1.5H2(g) 的平衡常数为K3,K2和K3的关系式为K2•K3=1;
由N2(g)+3H2(g)?2NH3(g)的平衡常数为K1、NH3(g)?0.5N2(g)+1.5H2(g) 的平衡常数为K3,K1和K3的关系式为K1•K32=1,
故答案为:K1=K22;K2•K3=1; K1•K32=1.
点评 本题考查化学平衡常数的含义、电离与水解、热化学反应等,为高频考点,把握相关反应原理为解答的关键,侧重分析与应用能力的考查,注意反应原理的应用,综合性较强,题目难度不大.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| 阳离子 | K+Na+Cu2+Al3+ |
| 阴离子 | SO42- HCO3-NO3-OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出B、C的化学式:BKNO3,CKAl(SO4)2.
(2)将含l mol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为Na2CO3.
(3)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3+3H+.
(4)在A溶液中加入过量澄清石灰水,其离子方程式为2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+H2O.
(5)向20mL 2mol/L C溶液中加入60mL E溶液,充分反应后得到0.78g沉淀,则E溶液的物质的量浓度可能是0.5和2.5moI/L.
| A. | HCHO--浸制标本 | B. | CH3COOC2H5--香料 | ||
| C. | CH3OH--饮料 | D. | CCl4--灭火剂 |
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 绿色化学的核心是利用化学原理治理环境污染 | |
| C. | 将煤气化或液化,获得清洁燃料 | |
| D. | 向高空排放金属冶炼产生的粉尘 |
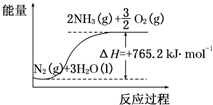 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为1.5×10-6 mol•h-1.
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是N2(g)+3H2O(l)=2NH3(g)+$\frac{3}{2}$O2(g)△H=+765.2kJ•mol-1.
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢.请提出可提高其反应速率且增大NH3生成量的建议:升高温度.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
 .
.