题目内容
1.m g Fe2O3、CuO的混合物,加入60mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液20mL;将m g的混合物用CO气体加热还原,实验过程中总共耗去标准状况下的CO 1.68升,得固体w g,w的值为( )| A. | m-0.48 | B. | m-0.72 | C. | m-0.8 | D. | m-1.2 |
分析 氧化物溶解于稀硫酸后,再向硫酸盐溶液中加氢氧化钠溶液,当刚出现沉淀时用去氢氧化钠,说明酸有剩余,根据氢氧化钠的物质的量计算剩余硫酸的物质的量;
除去剩余的硫酸就是与氧化物反应的硫酸,硫酸中氢离子和氧化物中的氧原子反应生成水,根据水的化学式知,和氧化物反应的硫酸的物质的量就等于氧原子的物质的量,CO还原氧化物得到的金属就等于氧化物的质量减去氧元素的质量.
解答 解:和硫酸反应的n(NaOH)=1.5mol/L×0.02L=0.03mol,硫酸和氢氧化钠反应的物质的量之比为1:2,所以与氢氧化钠反应的硫酸的物质的量是0.015mol,则与金属氧化物反应的n(H2SO4)=1.0mol/L×0.06L-0.015mol=0.045mol,根据H2O的化学式知,硫酸和氧原子的物质的量之比为1:1,所以氧化物中n(O)=0.045mol,即氧原子的质量=16g/mol×0.045mol=0.72g,
CO还原金属氧化物得到的金属质量=金属氧化物的质量-氧原子的质量=mg-0.72g,即w=m-0.72,
故选B.
点评 本题考查了有关混合物的计算,难度不大,明确反应过程中硫酸和氧原子的关系、金属氧化物和金属单质的关系是解本题的关键.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.下列反应的离子方程式书写正确的是( )
| A. | Fe和醋酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | FeCl2溶液与Cl2的反应:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
9.下列说法中正确的一组是( )
| A. |  互为同分异构体 互为同分异构体 | |
| B. |  与 与 两种烃互为同系物 两种烃互为同系物 | |
| C. | 甲苯与溴蒸汽的反应产物受反应条件的影响而不同 | |
| D. | H2和D2互为同位素 |
16.实验室在加热条件下,用二氧化锰跟浓盐酸反应可制备氯气,通常与其制备的发生装置相同的气体是( )
| A. | H2 | B. | HCl | C. | O2 | D. | CO2 |
6.某硫酸铝溶液中,含 Al3+ a g,则溶液中 SO42- 的物质的量为( )
| A. | $\frac{3a}{2}$ mol | B. | $\frac{a}{18}$ mol | C. | $\frac{a}{27}$ mol | D. | $\frac{a}{96}$ mol |
13.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 无色溶液中:Na+、Cl-、SO42-、Cu2+ | |
| B. | 滴加紫色石蕊试液显红色的溶液:NH4+、Fe2+、SO42-、NO3- | |
| C. | 滴加酚酞显红色的溶液:K+、Ba2+、Cl-、NO32- | |
| D. | 含有大量HS-的溶液:NH4+、Ca2+、H+、I- |
10.美国天文学家在亚利桑那州一天文观测台探测到了距银河系中心2.6亿光年处一巨大气云中的特殊电磁波这种电磁波表明那里可能有乙醇醛糖分子存在.下列有关乙醇醛糖(HOCH2CHO)的说法不正确的是( )
| A. | HOCH2CHO能发生取代反应、加成反应、氧化反应和还原反应 | |
| B. | 乙醇醛糖属于醛和糖的混合物 | |
| C. | HOCH2CHO与乙酸、甲酸甲酯互为同分异构体 | |
| D. | 乙醇醛糖与葡萄糖具有相似的化学性质 |
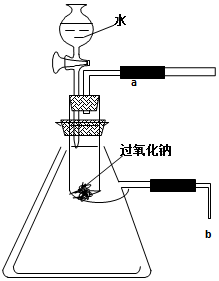 用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.