题目内容
6.在一密闭容器中,反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )| A. | 平衡逆向移动了 | B. | 物质A的转化率减小了 | ||
| C. | 物质B的质量分数增大了 | D. | 反应速率增大,且v正>v逆 |
分析 先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b,据此结合选项判断.
解答 解:先假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,比假设大,说明平衡向生成B的方向移动,即减小压强平衡向正反应方向移动,则a<b,
A、假设体积增加一倍时若平衡未移动,B的浓度应为原来的50%,实际平衡时B的浓度是原来的60%,大于原来的50%,说明平衡向生成B的方向移动,即向正反应移动,故A错误;
B、根据A的判断,平衡向正反应移动,A的转化率增大,故B错误;
C、平衡向正反应移动,B的质量增加,混合气体的总质量不变,故物质B的质量分数增大,故C正确;
D、将容器体积增加一倍,压强减小反应速率减小,正逆反应速率都减小,v正>v逆,故D错误;
故选C.
点评 本题考查化学平衡移动等,难度中等,注意利用假设法分析、判断平衡移动方向,掌握基础是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关说法正确的是( )
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H>0 | |
| B. | 准确量取24.00 mL的液体可选用滴定管、量筒或滴定管 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 在一密闭容器中发生2SO2(g)+O2(g)?2SO3(g)反应,增大压强,平衡会正向移动,$\frac{{c}^{2}({SO}_{3})}{{c}^{2}({SO}_{2})•c{(O}_{2})}$ 的值增大 |
 固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,反应①是实验室制备D的反应,则反应①的化学方程式为 。
固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,反应①是实验室制备D的反应,则反应①的化学方程式为 。
 D.CCl4
D.CCl4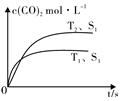 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下: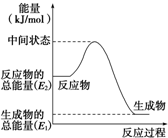 甲醇是人们开发和利用的一种新能源.已知:
甲醇是人们开发和利用的一种新能源.已知: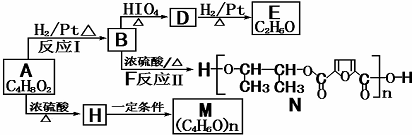
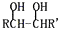 $→_{△}^{HIO_{4}}$RCHO+OHCR′
$→_{△}^{HIO_{4}}$RCHO+OHCR′
 .
.