题目内容
Ⅰ.已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去) ,请回答下列问题:
(1)请写出F的化学式 ;在②反应中,当生成2.24L的G(标准状况)时,反应中转移的电子的物质的量为 moL。
(2)若A、C、D均含有氯元素,且A中的化合价介于C与D之间,写出反应①的离子方程式: 。
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B分别为 、 。(写化学式)
(4)若A与B均为 固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,反应①是实验室制备D的反应,则反应①的化学方程式为 。
固体化合物,D是一种能使湿润的红色石蕊试纸变蓝的气体,反应①是实验室制备D的反应,则反应①的化学方程式为 。
Ⅱ.A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应产物略去)。

(1)若A是一种黄色非金属单质固体,则B→C的化学方程式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的电子式为 ,写出C和CO2反应的化学方程式,并标出单线桥 。
(3)若A是碱性气体,试写出A与氧气反应的化学方程式 。
练习册系列答案
相关题目
6.在一密闭容器中,反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )
| A. | 平衡逆向移动了 | B. | 物质A的转化率减小了 | ||
| C. | 物质B的质量分数增大了 | D. | 反应速率增大,且v正>v逆 |


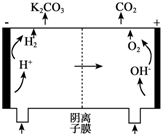 为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛.该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2.之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用.某研究小组用500mL 1mol/L K2CO3溶液吸收5.6L 的CO2(标准状况)形成富液(忽略溶液体积变化).
为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛.该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2.之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用.某研究小组用500mL 1mol/L K2CO3溶液吸收5.6L 的CO2(标准状况)形成富液(忽略溶液体积变化).