题目内容
18. 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是放热反应(填“吸热”或“放热”); 常温下,该反应能逆向自发进行,原因是逆反应方向的△S>0.
(2)下列有关该反应的说法正确的是BD.
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)燃煤和汽车尾气是造成空气污染产生雾霾的原因之一.消除汽车尾气是减少城市空气污染的热点研究课题.
已知:①N2(g)+O2(g)═2NO(g)△H═+180.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2 (g)△H═-283kJ•mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是2NO(g)+2CO(g)=N2(g)+2CO2(g))△H=-746.5kJ•mol-1.
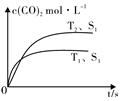
在密闭容器中发生上述反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,如图所示.已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(4)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等.
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是ADEF
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.0.1mol•L-1 HNO2溶液的pH═2.1
E.NaNO2和H3PO4反应,生成HNO2
F.常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是acd
a.H2O b.NO2- c.H2NCH2COOH d.H2PO4- e.H2S
③与氮同主族的磷元素形成的Na2HPO4溶液显碱性,若向该溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是3Ca2++2HPO42-═Ca3(PO4)2↓+2H+(用离子方程式表示).
(5)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种.下表是常温下浓度均为0.01mol•L-1的X、Y、Z、W溶液的pH.
| 0.01mol•L-1 的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
分析 (1)平衡常数K350℃<K300℃,说明温度升高时平衡逆向移动,△H-T△S<0时,反应能够自发进行;
(2)A、扩大容器体积,平衡逆向移动,但各组分浓度都减小;
B、恒温恒容下,再充入2molNO2和1molO2,相当于加压,平衡正向移动;
C、容器体积不变,气体质量不变;
D、正反应放热,降温平衡正向移动;
(3)应用盖斯定律解题,接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同;
(4)①部分电离的电解质是弱电解质,如果亚硝酸部分电离则亚硝酸是弱电解质,可以根据酸溶液或钠盐溶液的pH判断;
②所给微粒中既能结合H+又能提供H+的有H2PO4-、H2O和H2N-CH2COOH,因此这四种物质从酸碱质子理论的角度上看既是酸又是碱,即两性物质;
③若向Na2HPO4溶液中加入足量的CaCl2溶液,HPO42-离子和Ca2+离子反应生成沉淀,促进HPO42-的电离,溶液显示酸性;
(5)X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,溶液中的溶质为等物质的量浓度的硝酸钠和亚硝酸钠,亚硝酸钠能水解而使溶液呈碱性,则c(OH-)>c(H+),钠离子和硝酸根离子都不水解,但盐类水解较微弱,所以离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
解答 解:(1)温度升高时平衡逆向移动,说明正反应放热;该反应的正反应放热,则逆反应吸热,△H>0,若逆反应能够自发进行,则其,△H-T△S<0,必须要△S>0,故答案为:放热;逆反应方向的△S>0;
(2)A、扩大容器体积,无论平衡怎样移动,各组分浓度都减小,混合气体颜色变浅,故A错误;
B、与开始加入比例相同加入反应物,平衡正向移动,反应物转化率增大,故B正确;
C、容器中气体密度始终不变,所以密度不变不能说明反应达到平衡状态,故C错误;
D、降温平衡正向移动,化学平衡常数增大,故D正确;
故答案为:BD;
(3)由①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
②CO(g)+1/2O2(g)=CO2 (g)△H=-283kJ•mol-1
2×②-①得:2NO(g)+2CO(g)=N2(g)+2CO2(g))△H=-746.5kJ•mol-1,
接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T2到达平衡时相同,故c(CO2)在T2、S2条件下达到平衡过程中的变化曲线为: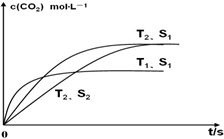 ,
,
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g))△H=-746.5kJ•mol-1; ;
;
(4)①A、亚硝酸钠溶液的pH>7,说明亚硝酸钠是强碱弱酸盐,其溶液呈碱性,所以能证明亚硝酸是弱酸,故A正确;
B、亚硝酸能与氢氧化钠发生中和反应只能说明亚硝酸具有酸性,不能说明亚硝酸的电离程度,所以不能证明亚硝酸是弱酸,故B错误;
C、用亚硝酸钠溶液作导电实验,灯泡很暗,不能说明亚硝酸的电离程度,所以不能证明亚硝酸是弱酸,故C错误;
D、常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4,说明稀释亚硝酸时,其氢离子物质的量增大,存在电离平衡,故D正确;
E.NaNO2和H3PO4反应,生成HNO2,磷酸是弱酸可以制备亚硝酸,说明亚硝酸为弱酸,故E正确;
F.常温下,将pH=3的亚硝酸溶液稀释10倍,若为强酸PH应为4,若为弱酸,溶液中存在电离平衡,加水稀释又电离溶液pH<4,故F正确;
故答案为:ADEF;
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱,质子就是氢离子.所给微粒中既能结合H+又能提供H+的有H2PO4-、H2O和H2N-CH2COOH,因此这四种物质从酸碱质子理论的角度上看既是酸又是碱,即两性物质,
故答案为:acd;
③HPO42-离子既能发生电离又能发生水解,电离反应式为HPO42-?PO43-+H+,水解反应式为HPO42-+H2O?H2PO4-+OH-,溶液呈碱性,说明水解程度大于电离程度;
由于HPO42-离子和Ca2+离子反应生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,促进HPO42-的电离,溶液则显酸性,
故答案为:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+;
(5)X、Y、Z各1mol•L-1同时溶于水中制得混合溶液,溶液中的溶质为等物质的量浓度的硝酸钠和亚硝酸钠,亚硝酸钠能水解而使溶液呈碱性,则c(OH-)>c(H+),钠离子和硝酸根离子都不水解,但盐类水解较微弱,所以离子浓度大小关系是c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);
点评 本题考查了反应自发进行的条件、化学平衡的移动、盐类水解以及离子浓度大小比较,图象的理解应用,考查范围广,题目难度较大.

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 平衡逆向移动了 | B. | 物质A的转化率减小了 | ||
| C. | 物质B的质量分数增大了 | D. | 反应速率增大,且v正>v逆 |
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,这是目前使用最广泛的人工固氮的方法.请回答下列问题:
450℃时,往一个2L的密闭容器中充入2.6molH2和1molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
此条件下该反应的化学平衡常数值为0.1
(2)若改变某一条件,达新平衡时n(H2)=1.6mol,下列说法正确的是BD
A.平衡一定正向移动
B.可能是降低了容器的温度
C.可能是向容器中加入了一定量的H2气体
D.可能是缩小了容器的体积
(3)另一种人工固氮的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和O2. 已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-489kJ/mol
请根据以上信息,写出人工固氮新方法的热化学方程式2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=1282.2KJ/mol
工业上也可在碱性溶液中通过电解的方法实现上述反应,阳极的电极反应式为4OH--4e-=O2↑+2H2O
(4)如图1表示500℃、60.0MPa条件下,合成氨原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数:14.5%.
(5)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:
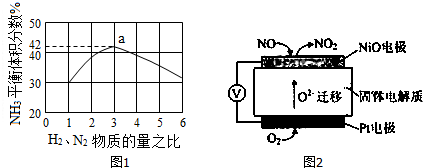
写出NiO电极的电极反应式:NO+O2--2e-=NO2
(6)①2NH3(g)+CO2(g)?NH2COONH4(s),此反应温度越低越容易自发进行,则该反应正向为放热反应(填“吸”或“放”).若将一定量NH2COONH4(s)置于恒温密闭容器中,其分解达到平衡状态,此时容器内压强为P1,混合气体的密度为ρ1.缩小容器的容积,再次达平衡时,容器内压强为P2,混合气体的密度为ρ2.则P1<P2(填“>”“=”或“<”),ρ1<ρ2(填“>”“=”或“<”).
②在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)?2C(g)+D(s)反应,按如表数据投料,反应达到平衡状态,测得体系压强升高.简述该反应的平衡常数与温度的变化关系:升高温度平衡常数减小
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H3=△H1+△H2或△H1=△H3-△H2或△H2=△H3-△H1.
(3)通过研究不同温度下平衡常数可以解决某些实际问题.已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
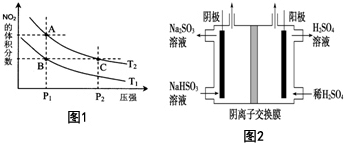
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图1所示.下列说法正确的是E:
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用图2装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,阳极区逸出气体的成分为O2、SO2(填化学式).
| A. | C3H7Cl | B. | C3H8 | C. | C4H10 | D. | C2H6O |
| A. | 原混合溶液中c(K+)为3mol/L | B. | 上述电解过程中共转移4 mol电子 | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 电解后溶液上c(H+)为4 mol/L |
