题目内容
15. 甲醇是人们开发和利用的一种新能源.已知:
甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol;
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ/mol
(1)甲醇蒸气完全燃烧的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H2=-764.7kJ/mol
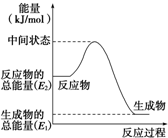
(2)反应②中的能量变化如图所示,则△H2=E1-E2kJ•mol-1
(3)H2(g)的燃烧热为285.9 kJ•mol-1.
分析 (1)②+①得CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l),依据盖斯定律计算反应热,写出热化学方程式;
(2)反应焓变△H=生成物总能量-反应物总能量,据此解答;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量.
解答 解:(1)①2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol;
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H2=-192.9kJ/mol;
由盖斯定律②+①得到甲醇蒸气完全燃烧的热化学反应方程式为:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-764.7kJ/mol;
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H2=-764.7kJ/mol;
(2)反应②中的能量变化如图所示,依据图象分析,反应焓变△H=生成物总能量-反应物总能量,△H2=E1-E2,
故答案为:E1-E2kJ•mol-1;
(3)燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,2H2(g)+O2(g)═2H2O(l)△H1=-571.8kJ/mol,则氢气燃烧热为285.9KJ/mol,
故答案为:285.9 kJ•mol-1.
点评 本题考查了反应热的计算、热化学方程式的书写、燃烧热的概念,明确盖斯定律计算反应热的方法是解题关键,题目难度不大.

练习册系列答案
相关题目
6.在一密闭容器中,反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )
| A. | 平衡逆向移动了 | B. | 物质A的转化率减小了 | ||
| C. | 物质B的质量分数增大了 | D. | 反应速率增大,且v正>v逆 |
3. 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H3=△H1+△H2或△H1=△H3-△H2或△H2=△H3-△H1.
(3)通过研究不同温度下平衡常数可以解决某些实际问题.已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示.
则该反应的正反应方向是放热反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为75%.
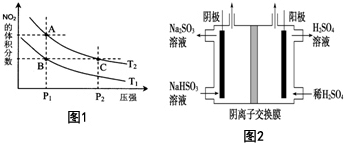
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图1所示.下列说法正确的是E:
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用图2装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,阳极区逸出气体的成分为O2、SO2(填化学式).
 化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H3=△H1+△H2或△H1=△H3-△H2或△H2=△H3-△H1.
(3)通过研究不同温度下平衡常数可以解决某些实际问题.已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图1所示.下列说法正确的是E:
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用图2装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,阳极区逸出气体的成分为O2、SO2(填化学式).
10.下列分子只表示一种物质的是( )
| A. | C3H7Cl | B. | C3H8 | C. | C4H10 | D. | C2H6O |
4.下列说法正确的是( )
| A. | 温度和压强一定时,对于可逆反应:2NO2(g)?N2O4(g),混合气体的密度不再改变,则反应达到平衡状态 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |

 A是一种重要的化工原料,用来衡量一个国家的石油化工发展水平,相同条件下存在如下转化关系(部分反应物、反应条件和产物已省略),其中E为具有果香气味的物质,F是高聚物.
A是一种重要的化工原料,用来衡量一个国家的石油化工发展水平,相同条件下存在如下转化关系(部分反应物、反应条件和产物已省略),其中E为具有果香气味的物质,F是高聚物.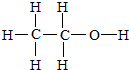 ;写出其官能团的电子式
;写出其官能团的电子式 ,1个该官能团含有9个电子,氢氧根与其组成元素相同,电子式为
,1个该官能团含有9个电子,氢氧根与其组成元素相同,电子式为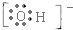 ,含有有10个电子;高聚物F是常用的塑料之一,它的链节可表示为-CH2CH2-.
,含有有10个电子;高聚物F是常用的塑料之一,它的链节可表示为-CH2CH2-.