题目内容
2.下列关于卤素的说法正确的是( )| A. | Cl2能与水反应,在反应中Cl2只能作氧化剂 | |
| B. | 氧化性Cl2>Br2>I2,还原性Cl->Br->I- | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 氯水具有酸性,可用pH试纸测量其pH值 |
分析 A、氯气与水、碱的反应中,既为氧化剂又是还原剂;
B、氧化性越强,对应阴离子的还原性越弱;
C.氯气不溶于饱和食盐水;
D、氯气与水反应生成盐酸和次氯酸,所以氯水具有盐酸、HClO的性质.
解答 解:A、氯气与水、碱的反应中,只有Cl元素化合价发生变化,既为氧化剂又是还原剂,故A错误;
B、氧化性越强,对应阴离子的还原性越弱,所以氧化性Cl2>Br2>I2,还原性Cl-<Br-<I-,故B错误;
C.氯气不溶于饱和食盐水,可用排饱和食盐水集气法收集,故C正确;
D、氯水中含有氢离子,能使pH试纸变红,由于氯水中次氯酸具有漂白性,故pH试纸后褪色,故D错误;
故选C.
点评 本题考查卤素原子的结构及其性质,为高频考点,侧重于学生的分析能力和,注意把握物质的性质的异同,难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
13.己知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1.下列判断错误的是( )
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1.下列判断错误的是( )
| A. | 等物质的量的CH4在反应①、②中转移电子数相同 | |
| B. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1. | |
| C. | 4NO2(g)+2N2(g)=8NO(g);△H=+586 kJ•mol-1 | |
| D. | 若用标准状况下4.48LCH4把NO2还原为N2,整个过程中转移1.6mol电子 |
10.下列不能说明氯元素的非金属性比硫元素强的是( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A. | ①⑤ | B. | ② | C. | ①④ | D. | ①③⑤ |
17.同周期的X、Y、Z三种元素,已知其最高价氧化物对应水化物的酸性:H3XO4<H2YO4<HZO4.下列判断正确的是( )
| A. | 非金属性:X>Y>Z | B. | 气态氢化物的稳定性:X>Y>Z | ||
| C. | 原子半径:X<Y<Z | D. | 对应阴离子的还原性:X>Y>Z |
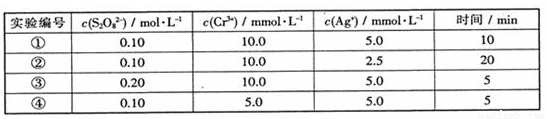
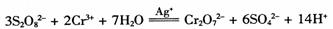 的反应速率与浓度的关系。反应速率v(Cr3+)可通过测定c(Cr3+)减半所需时间来确定。在一定温度下,获得如下实验数据:
的反应速率与浓度的关系。反应速率v(Cr3+)可通过测定c(Cr3+)减半所需时间来确定。在一定温度下,获得如下实验数据: