题目内容
10.下列不能说明氯元素的非金属性比硫元素强的是( )①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A. | ①⑤ | B. | ② | C. | ①④ | D. | ①③⑤ |
分析 比较非金属性可通过以下角度:氢化物的稳定性;与氢气反应的难易程度;最高价氧化物对应的水化物的酸性;单质之间的置换反应;对应阴离子的还原性强弱;与变价金属反应的化合价高低等.
解答 解:①元素的非金属性越强,对应的氢化物越稳定,HCl比H2S稳定,Cl比S非金属性强,故①正确;
②比较非金属性的强弱,根据最高价含氧酸的氧化性强弱来比较,最高价含氧酸的酸性越强,则元素的非金属性越强,HClO不是最高价含氧酸,故②错误;
③元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,HClO4酸性比H2SO4强,Cl比S非金属性强,故③正确;
④元素的非金属性越强,对应的单质的氧化性越强,Cl2能与H2S反应生成S,Cl比S非金属性强,故④正确;
⑤元素的非金属性越强,对应的单质的氧化性越强,Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,说明Cl2的氧化性大于S,则非金属性Cl大于S,故⑤正确;
故选B.
点评 本题考查非金属性的比较,学习中注意把握比较非金属性强弱的角度,题目难度不大.

练习册系列答案
相关题目
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,44g丙烷含有共价键的数目为9NA | |
| B. | 标准状况下,6.72 L NO2溶于足量的水中,转移电子的数目为0.3NA | |
| C. | 电解58.5g熔融的NaCl,能产生11.2L氯气、23.0g金属钠 | |
| D. | 1 L 1 mol.L-1的Na2CO3溶液中CO32-、HCO3-离子数目之和小于NA |
1.下列物质中,属电解质的是( )
| A. | 金属铜 | B. | 硝酸钾 | C. | 氯化钠溶液 | D. | 二氧化碳 |
18.实验室里需要480mL 0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
| A. | 称取12.5g胆矾配成500mL溶液 | B. | 称取8.0g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取7.68g硫酸铜,加入500mL水 |
5.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 12g金刚石中含σ键数为4 NA | |
| B. | 1mol Na2O2固体中含离子总数为4 NA | |
| C. | ag C2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{14}$ | |
| D. | 30g甲醛中含π键数为NA |
15.对 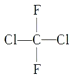 (商品名称为氟里昂-12,一种限制使用的制冷剂,类似于甲烷的结构)的叙述正确的是( )
(商品名称为氟里昂-12,一种限制使用的制冷剂,类似于甲烷的结构)的叙述正确的是( )
 (商品名称为氟里昂-12,一种限制使用的制冷剂,类似于甲烷的结构)的叙述正确的是( )
(商品名称为氟里昂-12,一种限制使用的制冷剂,类似于甲烷的结构)的叙述正确的是( )| A. | 有两种同分异构体 | B. | 是烷烃 | ||
| C. | 只有一种结构 | D. | 有四种同分异构体 |
2.下列关于卤素的说法正确的是( )
| A. | Cl2能与水反应,在反应中Cl2只能作氧化剂 | |
| B. | 氧化性Cl2>Br2>I2,还原性Cl->Br->I- | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 氯水具有酸性,可用pH试纸测量其pH值 |
 4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) (△H>0),在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”): 成速率为υ(CO)=18mol·L-1·min-1,则N2消耗速率为υ(N2)= 。
成速率为υ(CO)=18mol·L-1·min-1,则N2消耗速率为υ(N2)= 。