题目内容
20. 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
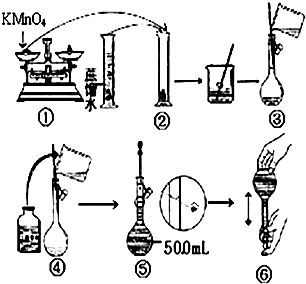
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:【配制KMnO4标准溶液】如图是配制50mLKMnO4标准溶液的过程示意图.
(1)上述过程中有两处错误,请你观察图示,判断其中不正确的操作是(填序号)②⑤.
(2)如果按照图示的操作配制溶液,所得的实验结果将偏小(填偏大或偏小).
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,共消耗12.00mL KMnO4溶液.
(3)滴定时,盛放高锰酸钾器名称为酸式滴定管,确定反应达到终点的现象滴入最后一滴标准溶液使溶液由无色变为紫红色,且半分钟内无变化.
(4)草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.
(5)根据所给数据计算血液样品中Ca2+离子的浓度为1.2mg/cm3.
分析 (1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)依据容量瓶的用途解答;依据仰视刻度线,会使溶液体积偏大判断,结合C=$\frac{n}{V}$分析;
(3)碱式滴定管能够量取碱性和非氧化性液体,酸性滴定管可以量取酸性和氧化性液体;草酸具有还原性,能够使高锰酸钾褪色;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒写出化学方程式;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
解答 解:(1)量筒为精密仪器,不能在量筒中溶解固体,故②错误,定容时应平视刻度线,至溶液凹液面与刻度线相切,⑤错误;
故选:②⑤;
(2)容量瓶是专门用来配制一定浓度溶液的精密仪器;如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小;
故答案为:偏小;
(3)酸性高锰酸钾具有强的氧化性,应盛放在酸式滴定管内;草酸具有还原性,能够使高锰酸钾褪色,向无色草酸中加入酸性高锰酸钾,当草酸反应完后,滴入最后一滴标准溶液使溶液由无色变为紫红色,且半分钟内无变化,滴定到达终点;
故答案为:酸式滴定管;滴入最后一滴标准溶液使溶液由无色变为紫红色,且半分钟内无变化;
(4)草酸跟酸性KMnO4溶液反应,离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=2.5×2.4×10-4mol=6×10-4mol,
Ca2+的质量为:40g/mol×6×10-4mol=0.024g,钙离子的浓度为:$\frac{0.024g}{20c{m}^{3}}$=0.0012g/cm3=1.2 mg/cm3,
故答案为:1.2.
点评 本题考查了配制一定物质的量浓度的方法及误差分析,氧化还原滴定,明确配置一定物质的量浓度原理和操作步骤、明确氧化还原滴定原理和操作是解题关键,侧重考查学生对实验基本知识的掌握情况,题目难度中等.

| A. | C6H5CH2OH | B. |  | C. |  | D. | CH3Cl |
| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
| A. | H2 | B. | CO | C. | CH3OH | D. | C2H5OH |
| A. | 标准状况下,11.2LCCl4中含有的分子数目为0.5NA | |
| B. | 常温下,1L0.1mol/LCH3COOH溶液中含有的H+数目为0.1NA | |
| C. | 25℃,PH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1L 1mol/L的NH4Cl溶液中,所含NH4+的数目小于NA |
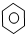 ③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中: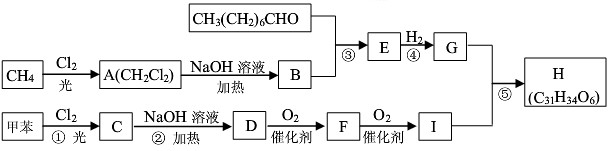
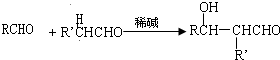
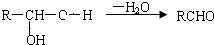
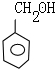 ,E
,E .
. .
.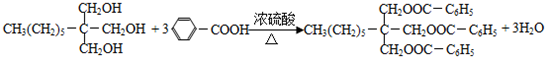 .
.