题目内容
在200mL含Mg2+、Al3+、NH4+、H+、Cl-离子的溶液中,逐滴加人4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mo1)的关系如图所示.下列叙述正确的是( )

| A、原溶液中n(Mg2+):n(A13+)=10:1 |
| B、原溶液中c(H+)=0.8mol/L |
| C、x与y的差值为0.08 |
| D、原溶液中c(C1-)=0.66mol/L |
考点:镁、铝的重要化合物,离子方程式的有关计算
专题:
分析:在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol?L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=
=0.08mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则C(NH4+)=
=0.06mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Mg2+)=
=0.2mol/L,c(Al3+)=
=0.04mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.04+2×0.2+0.06+0.08]mol/L=0.66mol/L,据此分析解答.
| 0.004L×4mol/L |
| 0.2L |
| (0.033-0.03)L×4mol/L |
| 0.2L |
则c(Mg2+)=
| ||
| 0.2L |
| 0.002L×4mol/L |
| 0.2L |
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.04+2×0.2+0.06+0.08]mol/L=0.66mol/L,据此分析解答.
解答:
解:在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入4mol?L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=
=0.08mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则C(NH4+)=
=0.06mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,
则c(Mg2+)=
=0.2mol/L,c(Al3+)=
=0.04mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.04+2×0.2+0.06+0.08]mol/L=0.66mol/L,
A.通过以上分析知,c(Mg2+)=0.2mol/L,c(Al3+)=0.04mol/L,同一溶液中体积相等,其物质的量之比等于物质的量浓度之比=0.2mol/L:0.04mol/L=5:1,故A错误;
B.通过分析知,c(H+)=
=0.08mol/L,故B错误;
C.x为Al(OH)3、Mg(OH)2的物质的量,y为Mg(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.04mol/L×0.2L=0.008mol,故C错误;
D.根据以上分析,原来溶液中c(Cl-)=0.66mol/L,故D正确;
故选D.
| 0.004L×4mol/L |
| 0.2L |
| (0.033-0.03)L×4mol/L |
| 0.2L |
则c(Mg2+)=
| ||
| 0.2L |
| 0.002L×4mol/L |
| 0.2L |
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.04+2×0.2+0.06+0.08]mol/L=0.66mol/L,
A.通过以上分析知,c(Mg2+)=0.2mol/L,c(Al3+)=0.04mol/L,同一溶液中体积相等,其物质的量之比等于物质的量浓度之比=0.2mol/L:0.04mol/L=5:1,故A错误;
B.通过分析知,c(H+)=
| 0.004L×4mol/L |
| 0.2L |
C.x为Al(OH)3、Mg(OH)2的物质的量,y为Mg(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.04mol/L×0.2L=0.008mol,故C错误;
D.根据以上分析,原来溶液中c(Cl-)=0.66mol/L,故D正确;
故选D.
点评:本题考查物质之间的反应,明确离子反应先后顺序是解本题关键,知道铝离子转化为氢氧化铝沉淀、偏铝酸钠时消耗NaOH的体积之比,结合电荷守恒解答,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、棉花、木材及草类的纤维都属于天然纤维 |
| B、所有分散系的分散质粒子都能透过半透膜 |
| C、16O与18O互为同素异形体 |
| D、H2、D2、T2互为同位素 |
下列措施不能加快锌与稀H2SO4反应速率的是( )
| A、加入少量CuSO4固体 |
| B、将Zn粒改为Zn粉 |
| C、增大压强 |
| D、加热 |
在2H2S+SO2═3S+2H2O的反应中当有4×6.02×1023个电子发生转移,得到氧化产物和还原产物的和为( )
| A、2mol | B、3mol |
| C、64g | D、32g |
下列物质中,既含有离子键又含有共价键的是( )
| A、氯化钠 | B、氢氧化钠 |
| C、水 | D、氯气 |
N0为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1.0L1.0mo1?L-1的NaAlO2水溶液中含有的氧原子数为2N0 |
| B、12g石墨烯(单层石墨)中含有六元环的个数为0.5N0 |
| C、25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 N0 |
| D、1mol的羟基与1 mol的氢氧根离子所含电子数均为9 N0 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,48gO3与O2混合气体中含氧原子数为3NA |
| B、1.8g的NH4+离子中含有的电子数为0.1NA |
| C、11.2L氧气中所含有的原子数为NA |
| D、标准状况下,22.4 LC6H14中所含碳原子数为6NA |
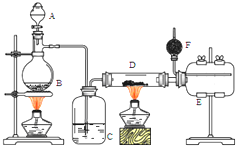 无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)═2AlCl3+3H2.完成下列填空: