题目内容
16.以下实验操作及现象合理的是( )| A. | 为检验SO42-需要滴加稀硝酸酸化的BaCl2溶液并观察是否有白色沉淀生成 | |
| B. | 把光洁无锈的铁丝放在煤气灯外焰灼烧至与原来的火焰颜色相同时,蘸取K2CO3溶液并灼烧,透过蓝色钴玻璃可观察到火焰为淡紫色 | |
| C. | 向盛有足量苯酚溶液的试管中滴加少量稀溴水,可观察到白色沉淀生成 | |
| D. | 实验室制备乙炔时,常用NaOH溶液除去产生的H2S、PH3等杂质 |
分析 A.不能排除SO32-需的干扰;
B.焰色反应可用铁丝,观察钾的焰色反应,可用蓝色钴玻璃滤去黄光;
C.苯酚过量,生成的三溴苯酚溶于苯酚;
D.氢氧化钠与磷化氢不反应.
解答 解:A.加稀硝酸酸化的BaCl2溶液,因硝酸具有强氧化性,可氧化SO32-生成SO42-,不能排除SO32-需的干扰,应先加入盐酸,再滴加氯化钡溶液,故A错误;
B.焰色反应可用铁丝,观察钾的焰色反应,可用蓝色钴玻璃滤去黄光,操作符合要求,故B正确;
C.滴加少量溴水,则苯酚过量,生成的三溴苯酚溶于苯酚,不能观察到沉淀生成,故C错误;
D.磷化氢性质与氨气相似,为碱性气体,氢氧化钠与磷化氢不反应,可用硫酸铜溶液除杂,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,题目涉及物质的分离、检验等操作,侧重分析与实验能力的考查,注意实验的评价性和可行性的分析,题目难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
12.下列关于硅及其化合物叙述中,正确的是( )
| A. | CO2和SiO2都能与水反应生成相应的酸 | |
| B. | 硅可以用做半导体材料,SiO2可用于制光导纤维 | |
| C. | 氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中 | |
| D. | 玻璃是人类最早使用的硅酸盐材料,玻璃加热熔化时有固定的熔点 |
7.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )


| A. | XZ线上任意点均呈中性,pH=7 | |
| B. | 两条曲线间任意点均有c(H+)•c(OH-)=Kw | |
| C. | M区域内任意点均有c(H+)<c(OH-) | |
| D. | 图中T1<T2 |
4.化学与生产、生活密切相关,下列叙述错误的是( )
| A. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| B. | 海水淡化的方法有蒸馏法、离子交换法和电渗析法等 | |
| C. | 用乙醚从黄花蒿中提取青蒿素利用了萃取原理 | |
| D. | 水泥厂常用高压电除去工厂烟尘,利用了胶体的性质 |
1.下列方程式或说法正确的是( )
| A. | 给氯化铜溶液通电发生的变化为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| B. | 少量CO2通入苯酚钠溶液中:C6H5O-+CO2+H2O=C6H5OH+HCO3- | |
| C. | 将足量CO2通入含H+、NH4+、Al3+、SO42-中会产生大量的白色沉淀 | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3•H2O+2H2O |
8.下图关于各实验装置(夹持装置已略去)的叙述,正确的是( )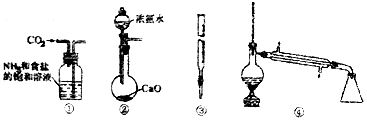

| A. | 装置①可用于模拟侯氏制碱法制取碳酸氢钠 | |
| B. | 装置②可用于制备少量NH3 | |
| C. | 装置③可用于准确取一定体积酸性KMnO4标准溶液 | |
| D. | 装置④常用于分离互不相溶的液体混合物 |
5.合成药物异搏定路线中某一步骤如图所示,下列说法错误的是( )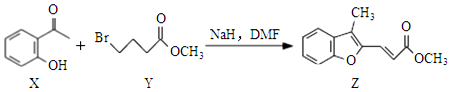
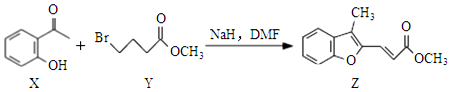
| A. | 物质X的分子中存在2种含氧官能团 | |
| B. | 物质Y可以发生水解和消去反应 | |
| C. | 1molZ最多可与2molBr2发生加成反应 | |
| D. | 等物质的量的X、Y分别与NaOH溶液反应,最多消耗的NaOH的物质的量之比为1:1 |
 (1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式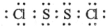 .
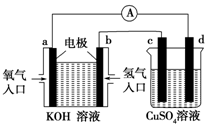
. 某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2