题目内容
1.6.5g锌恰好与125mL、2mo/L硝酸完全反应,则硝酸的还原产物为( )| A. | NO | B. | NO2 | C. | N2O | D. | NH4NO3 |
分析 分别计算出锌、硝酸的物质的量,锌反应后生成硝酸锌,设出反应后N元素化合价,利用氧化还原反应中得失电子相等列式计算.
解答 解:6.5gZn的物质的量是:$\frac{6.5g}{65g/mol}$=0.1mol,HNO3的物质的量是:2mol/L×0.125L=0.25mol,
设还原产物化合价是x,根据质量守恒生成硝酸锌的物质的量为0.1mol,其中表现酸性的HNO3的物质的量为:0.1×2=0.2mol,则被含有的硝酸的物质的量为:0.25mol-0.2mol=0.05mol,
据电子守恒可得:0.1mol×2=0.05mol×(5-x),解得:x=1,
所以硝酸的还原产物为:N2O,
故选C.
点评 本题考查了氧化还原反应的计算,题目难度不大,明确氧化还原反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
11.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 18g D2O所含电子数目为10NA | |
| B. | 实验室用含2molHCl的浓盐酸在加热下与足量的MnO2反应,转移的电子数为NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为4NA | |
| D. | 标准状况下,22.4 L氦气与18g水所含分子数均为NA |
9.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,8.8g CO2和N2O混合物中所含有的原子数为0.6 NA | |
| B. | 二氧化锰和浓盐酸反应产生4.48L气体时,转移的电子数为0.4NA | |
| C. | 标准状况下,3.36L水中含有电子数为1.5NA | |
| D. | 在0.2mol/L的硫酸铁溶液中含有的三价铁离子数为0.6 NA |
6.下列对反应现象的描述错误的是( )
| A. | 铝热反应发生时,火星四射并发出大量的热 | |
| B. | 将铜丝伸入浓硝酸中,产生红棕色气体 | |
| C. | 将二氧化硫通入品红溶液中,溶液褪色 | |
| D. | 氢气在氯气中燃烧,产生淡蓝色火焰 |
13.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H是相同的 |
10.化学在生产和日常生活中有着重要的应用.下列说法中不正确的是( )
| A. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 | |
| B. | 铝热反应不仅被用于焊接钢轨,而且还常被用于冶炼熔点较高的金属 | |
| C. | 电解AlCl3饱和溶液,可制得金属铝 | |
| D. | Al2O3、MgO的熔点很高,可用于制作耐高温材料 |
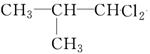 、
、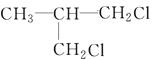 、
、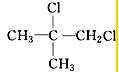 .
.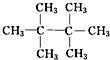 .
.