题目内容
10.化学在生产和日常生活中有着重要的应用.下列说法中不正确的是( )| A. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 | |
| B. | 铝热反应不仅被用于焊接钢轨,而且还常被用于冶炼熔点较高的金属 | |
| C. | 电解AlCl3饱和溶液,可制得金属铝 | |
| D. | Al2O3、MgO的熔点很高,可用于制作耐高温材料 |
分析 A.Al的表面易形成致密的氧化膜;
B.铝具有较强的还原性,铝热反应会放出大量热;
C.AlCl3饱和溶液中氢离子的得电子能力大于铝离子;
D.Al2O3、MgO的熔点在两千摄氏度以上.
解答 解:A.Al的表面易形成致密的氧化膜,能保护内部金属不被腐蚀,Fe表面形成疏松的氧化膜,不能保护内部金属,所以铝制品比铁制品在空气中耐腐蚀,故A正确;
B.铝具有较强的还原性,铝热反应会放出大量热,铝热反应生成的铁单质为液体可以用于焊接钢轨,故B正确;
C.AlCl3饱和溶液中氢离子的得电子能力大于铝离子,所以在阴极上氢离子得电子生成氢气,铝离子不能被电解,所以得不到金属铝,故C错误;
D.Al2O3、MgO的熔点在两千摄氏度以上,熔点很高,可用于制作耐高温材料,故D正确.
故选C.
点评 本题考查了铝及其化合物的性质,题目难度不大,注意把握常见元素化合物的性质,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
20.利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是( )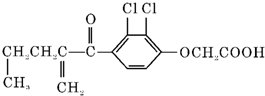

| A. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14O4Cl2 | |
| B. | 利尿酸不能发生酯化反应 | |
| C. | 1 mol利尿酸能与7 mol H2发生加成反应 | |
| D. | 利尿酸不能与FeCl3溶液发生显色反应 |
1.6.5g锌恰好与125mL、2mo/L硝酸完全反应,则硝酸的还原产物为( )
| A. | NO | B. | NO2 | C. | N2O | D. | NH4NO3 |
18.下列有关能量转换的说法正确的是( )
| A. | 原电池是将电能转化为化学能的过程 | |
| B. | 煤燃烧是化学能转化为热能的过程 | |
| C. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
5.在2A+B?3C+5D反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=60 mol/(L•min) |
15.设nA为阿伏伽德罗常数的数值,下列说法正确的是(相对原子质量Na 23)( )
| A. | 23g Na 与足量H2O反应完全后可生成nA个H2分子 | |
| B. | 1 mol乙烯分子含有2nA碳碳双键 | |
| C. | 标况下,22.4LN2和H2混合气中含nA个原子 | |
| D. | 标况下,22.4LCl2与足量Fe和Cu混合物点燃,反应后,转移的电子数为2nA个 |
19.相同条件下列四种稀硫酸溶液,均能与锌片反应,其中最初反应速率最快的是( )
| A. | 20mL 0.3mol/L的硫酸溶液 | B. | 30mL 0.2mol/L的硫酸溶液 | ||
| C. | 20mL 0.2mol/L的硫酸溶液 | D. | 10mL 0.4mol/L的硫酸溶液 |