题目内容
11.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 18g D2O所含电子数目为10NA | |
| B. | 实验室用含2molHCl的浓盐酸在加热下与足量的MnO2反应,转移的电子数为NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为4NA | |
| D. | 标准状况下,22.4 L氦气与18g水所含分子数均为NA |
分析 A、重水的摩尔质量为20g/mol,而重水中含10个电子;
B、二氧化锰只能与浓盐酸反应,和稀盐酸不反应;
C、二氧化碳和氧气分子中均含2个氧原子;
D、根据分子个数N=$\frac{V}{Vm}{N}_{A}$和N=$\frac{m}{M}{N}_{A}$来计算.
解答 解:A、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,而重水中含10个电子,故0.9mol重水中含9NA个电子,故A错误;
B、二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故当盐酸变稀后反应即停止,故转移的电子数小于NA个,故B错误;
C、二氧化碳和氧气分子中均含2个氧原子,故NA个二氧化碳和氧气分子的混合物中含有2NA个氧原子,故C错误;
D、标况下22.4L氦气中含有的分子个数N=$\frac{V}{Vm}{N}_{A}$=$\frac{22.4L}{22.4L/mol}×{N}_{A}/mol$=NA个,18g水中含有的分子个数N=$\frac{m}{M}{N}_{A}$=$\frac{18g}{18g/mol}×{N}_{A}/mol={N}_{A}$个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
2.氧氟沙星是常用抗菌药,其结构简式如图所示,下列对氧氟沙星叙述错误的是( )
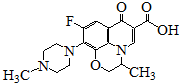

| A. | 能发生加成、取代反应 | |
| B. | 一定条件下,1mol该物质最多消耗5mol H2 | |
| C. | 分子内共有19个氢原子 | |
| D. | 分子内共平面的碳原子多于6个 |
19.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,下列说法正确的是( )
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 此有机物一定是烃CH4 | D. | 分子中可能含有氧原子 |
16.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 50g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| B. |  12g石墨烯(如图)中含有C-C键的数目为1.5NA 12g石墨烯(如图)中含有C-C键的数目为1.5NA | |
| C. | 常温下,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 一定量的Na2O2与H2O反应产生1.12L O2,则反应中转移的电子数为0.1NA |
3.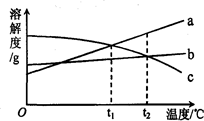 a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
( )
 a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是( )
| A. | 原饱和溶液中,溶质的质量分数a>b=c | |
| B. | 恢复至t2℃时,析出溶质的质量a>b=c | |
| C. | 恢复至t2℃时,三种溶液一定都是饱和溶液 | |
| D. | 若继续降温至t1℃,三种溶液一定都是饱和溶液 |
20.利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是( )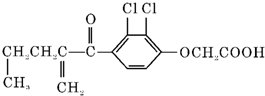

| A. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14O4Cl2 | |
| B. | 利尿酸不能发生酯化反应 | |
| C. | 1 mol利尿酸能与7 mol H2发生加成反应 | |
| D. | 利尿酸不能与FeCl3溶液发生显色反应 |
1.6.5g锌恰好与125mL、2mo/L硝酸完全反应,则硝酸的还原产物为( )
| A. | NO | B. | NO2 | C. | N2O | D. | NH4NO3 |