题目内容
根据碘与氢气反应的热化学方程式下列判断正确的是( )
(i) I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
(ii) I2(S)+H2(g)2HI(g)△H=+26.48kJ.
(i) I2(g)+H2(g) 2HI(g)△H=-9.48kJ/mol
(ii) I2(S)+H2(g)2HI(g)△H=+26.48kJ.
| A、1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C、反应(i)的产物比反应(ii)的产物稳定 |
| D、反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
考点:反应热和焓变
专题:
分析:已知:①I2(g)+H2(g)?2HI(g)△H=-9.48kJ?mol-1;②I2(s)+H2(g)?2HI(g)△H=+26.48kJ?mol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJ?mol-1-26.48kJ?mol-1=-35.96kJ?mol-1,根据二者转化的热化学方程式判断.
解答:
解:已知:①I2(g)+H2(g)?2HI(g)△H=-9.48kJ?mol-1;②I2(s)+H2(g)?2HI(g)△H=+26.48kJ?mol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJ?mol-1-26.48kJ?mol-1=-35.96kJ?mol-1,
A.n(I2)=1moL,n(H2)=1mol,由于该反应为可逆反应,则放出的热量小于9.48kJ,故A错误;
B.由I2(g)=I2(s)△H=-35.96kJ?mol-1,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误;
C.反应①、②的产物都是HI,状态相同,稳定性相同,故C错误;
D.由I2(g)=I2(s)△H=-35.96kJ?mol-1,可知I2(g)能量大于I2(s),故D正确.
故选D.
A.n(I2)=1moL,n(H2)=1mol,由于该反应为可逆反应,则放出的热量小于9.48kJ,故A错误;
B.由I2(g)=I2(s)△H=-35.96kJ?mol-1,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误;
C.反应①、②的产物都是HI,状态相同,稳定性相同,故C错误;
D.由I2(g)=I2(s)△H=-35.96kJ?mol-1,可知I2(g)能量大于I2(s),故D正确.
故选D.
点评:本题考查化学反应与能量,明确盖斯定律的应用是解答该题的关键,注意物质的稳定性与能量高低的关系,易错点为A,注意反应为可逆反应的特征.

练习册系列答案
相关题目
 取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )
取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现b电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色.则下列说法错误的是( )| A、a电极是阴极 |
| B、电解过程中水是氧化剂 |
| C、a电极附近溶液的pH变小 |
| D、b极电极反应式为:2Cl--2e-═Cl2↑ |
X、Y、Z均为第三周期元素,X的第一电离能在同周期中最小,Y的电负性在同周期中最大,Z的离子半径在同周期中最小,下列关于X、Y、Z叙述中不正确的是( )
| A、原子序数和原子半径大小顺序均为:X<Y<Z |
| B、元素X与元素Y能形成离子化合物 |
| C、元素Z最高价氧化物对应水化物具有两性 |
| D、元素Y形成的气态氢化物水溶液呈强酸性 |
将如图中所示实验装置的K闭合,下列判断正确的是( )
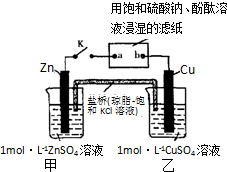

| A、电子沿Zn→a→b→Cu路径流动 |
| B、Cu电极上发生氧化反应 |
| C、甲池与乙池中的溶液互换,闭合K仍有电流产生 |
| D、片刻后可观察到滤纸a点变红色 |
下列叙述正确的是( )
| A、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| B、增大压强是通过提高活化分子的百分数来提高反应速率 |
| C、氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| D、水煤气是可再生能源 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温常压下,18克H2O含有2NA个氢原子 |
| B、1mol的Cl2与足量的NaOH溶液反应转移的电子数为2NA |
| C、1mol苯分子中含有的碳碳双键数为3 NA |
| D、5mol/L的Na2CO3溶液中含有的CO32-数目小于0.5 NA |