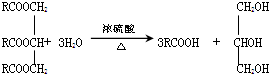
题目内容
 在一个固定容积的密闭容器中发生如下反应:
在一个固定容积的密闭容器中发生如下反应:N2 (g)+3H2 (g)
| △ |
在不同时间段里化学反应速率随时间变化如图所示,据此判断下列说法正确的是( )
| A、处于平衡状态的只有t1~t2段 |
| B、t1~t2段c(NH3)最大 |
| C、在t2时可能是向容器中充入了少量He |
| D、在t4时可能是升高温度 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:由图象可知,在t1-t2,t3-t4,t4-t5三段,v(正)=v(逆),反应处于平衡状态,t1-t2平衡阶段的基础上正逆反应速率都增大,且逆反应速率大于正反应速率,反应由平衡变化到新的平衡,结合图象的曲线变化特点解答该题.
解答:
解:A、在t1-t2,t3-t4,t4-t5三段,v(正)=v(逆),反应都处于平衡状态,故A错误;
B、在平衡t1-t2段的基础上正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,c(NH3)减小,达到新的平衡后,平衡再没有移动,所以,t1~t2段c(NH3)最大,故B正确;
C、在固定容积的密闭容器充入不相关的气体He,对平衡无影响,故C错误;
D、该反应的△H<0,温度升高时平衡向逆向移动,t4后平衡并没有发生移动,故D错误.
故选B
B、在平衡t1-t2段的基础上正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,c(NH3)减小,达到新的平衡后,平衡再没有移动,所以,t1~t2段c(NH3)最大,故B正确;
C、在固定容积的密闭容器充入不相关的气体He,对平衡无影响,故C错误;
D、该反应的△H<0,温度升高时平衡向逆向移动,t4后平衡并没有发生移动,故D错误.
故选B
点评:本题考查化学反应速率与化学平衡的图象问题,题目难度不大,本题注意分析图象曲线的变化趋势,把握外界条件对反应速率和平衡移动的影响.

练习册系列答案
相关题目
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )| A、增大A的浓度 |
| B、增大容器的体积 |
| C、加入催化剂 |
| D、升高温度 |
短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数的差是8,A原子的最外层电子数是其次外层电子数的3倍,在同周期主族元素中B原子的原子半径最大.下列说法正确的是( )
| A、气态氢化物的热稳定性:A<C |
| B、元素A与B只能形成一种化合物 |
| C、元素B与D形成的化合物是离子化合物 |
| D、最高价氧化物对应的水化物的酸性:C>D |
在体积不变的密闭容器中,2NO2(g)?N2O4(g) 达到平衡的标志是( )
①消耗1mol NO2 的同时消耗1mol N2O4 ②容器内NO2和N2O4的物质的量相等
③混合气体的颜色不再改变 ④容器内NO2的物质的量浓度不再变化.
①消耗1mol NO2 的同时消耗1mol N2O4 ②容器内NO2和N2O4的物质的量相等
③混合气体的颜色不再改变 ④容器内NO2的物质的量浓度不再变化.
| A、①② | B、①②③ |
| C、③④ | D、①③④ |
用铂电极电解100mL HNO3与 AgNO3 的混合液,通电一段时间后,两极均收集到2.24L气体(标准状况),则要使溶液复原应加入( )
| A、0.2molAg2O |
| B、0.2 mol H2O |
| C、0.4mol AgNO3. |
| D、0.2 molAgOH |
几种短周期元素的原子半径及主要化合价如下表:
下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A、元素X和Q形成的化合物中不可能含有共价键 |
| B、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| C、R3-比Q2-更容易失去电子 |
| D、M(OH)2的碱性比XOH的碱性强 |
在水溶液中能大量共存的一组离子是( )
| A、H+、Na+、SO42-、SiO32- |
| B、Ba2+、Al3+、Cl-、SO42- |
| C、K+、Mg2+、SO42-、NO3- |
| D、H+、Fe2+、ClO-、NO3- |