题目内容
除去下列物质中所混有的少量杂质,指明应加入的试剂的化学式或名称,写出有关的反应方程式.
(1)铜粉中混有少量铝粉 、 ;
(2)FeCl3中混有少量FeCl2、 ;
(3)Na2CO3固体中混有少量NaHCO3 、 .
(1)铜粉中混有少量铝粉
(2)FeCl3中混有少量FeCl2、
(3)Na2CO3固体中混有少量NaHCO3
考点:物质的分离、提纯的基本方法选择与应用
专题:元素及其化合物,化学实验基本操作
分析:(1)铝能与氢氧化钠溶液反应生成溶于水的偏铝酸钠,可用氢氧化钠溶液除杂;
(2)FeCl2可与Cl2反应生成FeCl3;
(3)NaHCO3不稳定,加热易分解.
(2)FeCl2可与Cl2反应生成FeCl3;
(3)NaHCO3不稳定,加热易分解.
解答:
解:(1)铝能与氢氧化钠溶液反应生成溶于水的偏铝酸钠,可用氢氧化钠溶液除杂,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:NaOH;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)FeCl2可与Cl2反应生成FeCl3,可加入氯水除杂,反应的化学方程式为2FeCl2+Cl2=2FeCl3,
故答案为:氯水;2FeCl2+Cl2=2FeCl3;
(3)NaHCO3不稳定,加热易分解,则可用加热的方法除杂,反应的方程式为2NaHCO3
Na2CO3+CO2+H2O,
故答案为:加热;2NaHCO3
Na2CO3+CO2+H2O.
故答案为:NaOH;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)FeCl2可与Cl2反应生成FeCl3,可加入氯水除杂,反应的化学方程式为2FeCl2+Cl2=2FeCl3,
故答案为:氯水;2FeCl2+Cl2=2FeCl3;
(3)NaHCO3不稳定,加热易分解,则可用加热的方法除杂,反应的方程式为2NaHCO3
| ||
故答案为:加热;2NaHCO3
| ||
点评:本题考查物质的分离、提纯,侧重于学生的分析能力和元素化合物知识的考查,为高频考点,注意把握物质的性质的异同,把握相关方程式的书写,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是( )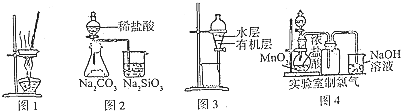

| A、用图l所示装置蒸干AlC13饱和溶液制备AlCl3晶体 |
| B、用图2所示装置证明非金属性Cl>C>Si |
| C、用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层 |
| D、用图4所示装置制取少量Cl2气体 |
正确表示下列反应的离子方程式是( )
| A、碳酸氢钙溶液和氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O |
| B、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、硝酸铝溶液中加入过量氨水:Al3++NH3?H2O═AlO2-+4NH4++2H2O |
| D、硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓ |
 在一个固定容积的密闭容器中发生如下反应:
在一个固定容积的密闭容器中发生如下反应:N2 (g)+3H2 (g)
| △ |
在不同时间段里化学反应速率随时间变化如图所示,据此判断下列说法正确的是( )
| A、处于平衡状态的只有t1~t2段 |
| B、t1~t2段c(NH3)最大 |
| C、在t2时可能是向容器中充入了少量He |
| D、在t4时可能是升高温度 |
下列各组离子中,在酸性溶液中能大量共存的离子组是( )
| A、Na+、MnO4-、Mg2+、NO3- |
| B、Na+、Ba2+、SO42-、Br- |
| C、K+、SCN-、Fe3+、Cl- |
| D、K+、AlO2-、Cl-、SO42- |