题目内容
在体积不变的密闭容器中,2NO2(g)?N2O4(g) 达到平衡的标志是( )
①消耗1mol NO2 的同时消耗1mol N2O4 ②容器内NO2和N2O4的物质的量相等
③混合气体的颜色不再改变 ④容器内NO2的物质的量浓度不再变化.
①消耗1mol NO2 的同时消耗1mol N2O4 ②容器内NO2和N2O4的物质的量相等
③混合气体的颜色不再改变 ④容器内NO2的物质的量浓度不再变化.
| A、①② | B、①②③ |
| C、③④ | D、①③④ |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:①、消耗1mol NO2 的同时消耗1mol N2O4,速率之比不等于化学计量数之比,故①错误;
②、容器内NO2和N2O4的物质的量可能相等,也可能不等,与各物质的初始浓度及转化率有关,故②错误;
③、混合气体的颜色不再改变,说明NO2(g)的浓度不变,正逆速率相等,故③正确;
④、容器内NO2的物质的量浓度不再变化,正逆速率相等,故④正确;
故选C.
②、容器内NO2和N2O4的物质的量可能相等,也可能不等,与各物质的初始浓度及转化率有关,故②错误;
③、混合气体的颜色不再改变,说明NO2(g)的浓度不变,正逆速率相等,故③正确;
④、容器内NO2的物质的量浓度不再变化,正逆速率相等,故④正确;
故选C.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是( )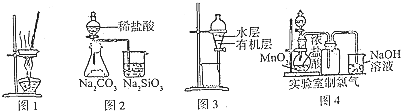

| A、用图l所示装置蒸干AlC13饱和溶液制备AlCl3晶体 |
| B、用图2所示装置证明非金属性Cl>C>Si |
| C、用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层 |
| D、用图4所示装置制取少量Cl2气体 |
将c(H+)=1×10-2mol?L-1的CH3COOH和HNO3溶液分别加水稀释100倍,稀释后两溶液的c(H+)分别为a和b.则a和b的关系为( )
| A、a>b | B、a=b |
| C、a<b | D、不能确定 |
 在一个固定容积的密闭容器中发生如下反应:
在一个固定容积的密闭容器中发生如下反应:N2 (g)+3H2 (g)
| △ |
在不同时间段里化学反应速率随时间变化如图所示,据此判断下列说法正确的是( )
| A、处于平衡状态的只有t1~t2段 |
| B、t1~t2段c(NH3)最大 |
| C、在t2时可能是向容器中充入了少量He |
| D、在t4时可能是升高温度 |
下列说法中,不正确的是( )
| A、标准状况下,22.4L H2和O2的混合气体中所含的分子数为NA |
| B、21.6g X单质与Cl2完全反应,生成106.8gX Cl3,则X的相对原子质量为27 |
| C、浓度均为0.10mol?L-1的醋酸和醋酸钠溶液等体积混合后:c(CH3COO-)-(CH3COOH)=2[c(H+)-c(OH-)] |
| D、500mL 0.10mol?L-1 FeSO4溶液中,Fe2+的物质的量浓度是0.10mol?L-1 |
用铂作电极电解某金属氯化物MCln的水溶液,当阳极产生a mol气体时,阴极析出m g金属(无气体生成),则金属的相对原子质量是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
汽车尾气中的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )
| A、氮氧化物 | B、氮气 |
| C、水蒸气 | D、氧气 |
在pH=1的溶液中,能大量共存的一组离子是( )
| A、Mg2+、Ca2+、HCO3-、NO3- |
| B、Al3+、NH4+、Br-、Cl- |
| C、K+、MnO4-、S2-、SO42- |
| D、Na+、K+、SiO32-、Cl- |