题目内容
16. 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
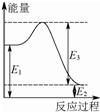
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
分析 (1)氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ•mol-1;依据热化学方程式和盖斯定律计算得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式;
(2)根据反应热与反应物的物质的量成正比来解答;根据反应热应等于生成物与反应物的能量之差分析;
(3)依据化学反应的焓变=反应物总键能-生成物总键能.
解答 解:(1)2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1,即1mol氢气完全燃烧生成液态水放出的热量285.8 kJ,故氢气的燃烧热为△H=-285.8 kJ•mol-1,
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
依据盖斯定律①+②得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1,
故答案为:△H=-285.8 kJ•mol-1;CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1;
(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差,
故答案为:0.75;C;
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到
△H1=1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1,
故答案为:-116 kJ•mol-1.
点评 本题主要考查了热化学方程式的意义,盖斯定律的运用,有关反应热的计算,难度不大,注意计算的准确性.

 阅读快车系列答案
阅读快车系列答案| A. | CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOHCH2CH3+H2O | |
| B. | 2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O | |
| C. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| D. | CH3CH2OH+HBr→CH3CH2Br+H2O |
| A. | 中子数为8的氮原子:8N | |
| B. | 次氯酸的电子式: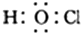 | |
| C. | PCl5分子的每个原子都满足8电子稳定结构 | |
| D. | 用电子式表示NaCl的形成过程: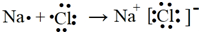 |
| A. | D元素处于元素周期表中第三周期ⅣA族 | |
| B. | 四种元素的原子半径:A<B<D<C | |
| C. | B、D的氧化物均为酸性氧化物 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 第4周期 | ② | ④ |
(2)③④⑤三种元素最高价氧化物对应水化物中,碱性最强的是Ca(OH)2(填化学式),该物质含有的化学键类型是离子键和共价键.
(3)元素⑦的氢化物常温下和元素①的单质反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(4)①和⑦两元素形成四核化合物的电子式是
 .
.(5)元素⑧与元素⑨相比,非金属性较强的是Cl>S(用元素符号表示),下列表述中能证明这一事实的是bd(填序号).
a.与金属化合时,每个硫原子比每个氯原子得电子数多
b.⑨的氢化物比⑧的氢化物稳定
c.一定条件下⑧和⑨的单质都能与氢氧化钠溶液反应
d.最高价氧化物对应水化物酸性⑨比⑧强
(6)元素②的最高价氧化物的水化物与⑤的最高价氧化物的水化物反应的离子方程式为:OH-+Al(OH)3=AlO2-+H2O.
| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
①甲烷 ②乙烯 ③丙炔 ④苯 ⑤甲苯 ⑥乙醇 ⑦乙醛 ⑧乙酸乙酯.
| A. | 只有⑤ | B. | ⑤⑥ | C. | ①④⑧ | D. | ②③⑤⑦ |
| A. | 肯定是x+2 | B. | 肯定是x+2或x+8或x+32 | ||
| C. | 肯定是x+2或x+12或x+26 | D. | 肯定是x+2或x+10或x+26 |