题目内容
8.重水(21D2O)是重要的核工业原料,下列说法错误的是( )| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
分析 A.同种元素形成的不同单质互为同素异形体;
B.具有相同质子数、不同中子数的原子互为同位素;
C.原子的核外电子数等于质子数;
D.依据所给原子的质量数分别计算相对分子质量,据此分析.
解答 解:A.H2O与D2O均为水,属于化合物,不互为同素异形体,故A错误;
B.1H与D具有相同质子数、不同中子数,二者互称同位素,故B正确;
C.氘(D)原子内有1个质子,原子的核外电子数等于质子数,核外有1个电子,故C正确;
D.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质为2×2+16=20,故D正确;
故选A.
点评 本题考查同素异形体及同位素,把握相关的概念及核变化为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列化学用语正确的是( )
| A. | 氯化钠的电子式: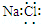 | |
| B. | 聚乙烯的结构简式: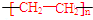 | |
| C. | 硫离子的结构示意图: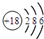 | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
16. 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
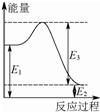
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
则△H1=-116kJ•mol-1.
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
13.下列变化中,不需要破坏化学键的是( )
| A. | 碘升华 | B. | 加热氯酸钾使其分解 | ||
| C. | 氯化氢溶于水 | D. | 氯化钠溶于水 |
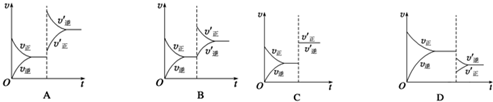
20.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂 B适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
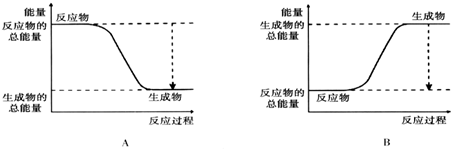
(2)如图能正确表示该反应中能量变化的是A.
(3)从断键和成键的角度分析上述反应中能量的变化.
请填写下表:
(4)现有如下两个反应:A:NaOH+HCl=NaCl+H2O;B:Fe+2Fe3+=3Fe2+,根据两反应的本质,B能设计成为原电池(填A或B),请画出该原电池装置图.

(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂 B适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.

(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
| 化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
| 拆开化学键 | 2molH2中的化学键 | ①吸收热量 | ④1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | ②放出热量 | ⑤1852 |
| 总能量变化 | ③放出热量 | ⑥484 | |

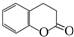 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(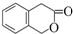 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.