题目内容
5.下列有机物中能使酸性KMnO4溶液褪色,但不能使溴水因发生反应而褪色的是( )①甲烷 ②乙烯 ③丙炔 ④苯 ⑤甲苯 ⑥乙醇 ⑦乙醛 ⑧乙酸乙酯.
| A. | 只有⑤ | B. | ⑤⑥ | C. | ①④⑧ | D. | ②③⑤⑦ |
分析 能使酸性KMnO4溶液褪色,但不能使溴水因发生反应而褪色,则有机物不能含碳碳双键、三键,不能为酚、醛等,可能为苯的同系物、醇等,以此来解答.
解答 解:①甲烷与高锰酸钾、溴水均不反应,故不选;
②乙烯与高锰酸钾、溴水均反应,故不选;
③丙炔与高锰酸钾、溴水均反应,故不选;
④苯与高锰酸钾、溴水均不反应,故不选;
⑤甲苯与高锰酸钾反应,与溴水不反应,故选;
⑥乙醇与高锰酸钾反应,与溴水不反应,故选;
⑦乙醛与高锰酸钾、溴水均反应,故不选;
⑧乙酸乙酯与高锰酸钾、溴水均不反应,故不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及有机反应,题目难度不大.

练习册系列答案
相关题目
15.对与反应2HI(g)?H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是( )
| A. | 温度和体积一定时,容器内压强不再变化 | |
| B. | 生成H2和生成HI的速率相等 | |
| C. | 混合气体的颜色不再变化 | |
| D. | 各物质的物质的量浓度之比为2:1:1 |
16. 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
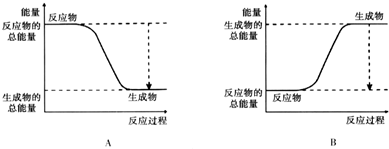
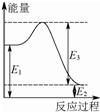
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
则△H1=-116kJ•mol-1.
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热为△H=-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
13.下列变化中,不需要破坏化学键的是( )
| A. | 碘升华 | B. | 加热氯酸钾使其分解 | ||
| C. | 氯化氢溶于水 | D. | 氯化钠溶于水 |
20.从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O.
(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂 B适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
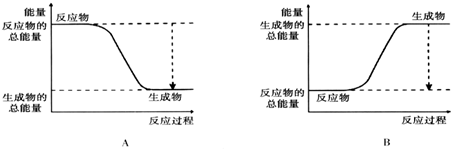
(2)如图能正确表示该反应中能量变化的是A.
(3)从断键和成键的角度分析上述反应中能量的变化.
请填写下表:
(4)现有如下两个反应:A:NaOH+HCl=NaCl+H2O;B:Fe+2Fe3+=3Fe2+,根据两反应的本质,B能设计成为原电池(填A或B),请画出该原电池装置图.

(1)为了加快正反应速率,可以采取的措施有ABC(填序号,下同).
A.使用催化剂 B适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)如图能正确表示该反应中能量变化的是A.

(3)从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
| 化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
| 拆开化学键 | 2molH2中的化学键 | ①吸收热量 | ④1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | ②放出热量 | ⑤1852 |
| 总能量变化 | ③放出热量 | ⑥484 | |

10.可以把5种无色溶液:乙醇、苯酚、Na2CO3溶液、AgNO3溶液、KOH溶液一一区分的试剂是( )
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
15.下列物质的转化在给定条件下能实现的是( )
| A. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe | |
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | |
| D. | Cu(OH)2 $\stackrel{HNO_{3}(ap)}{→}$Cu(NO3)2(aq)$\stackrel{蒸发}{→}$Cu(NO3)2晶体 |
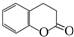 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(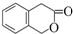 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.