题目内容
12.钠、铝、铁是中学化学常见的三种金属.下列说法中正确的是( )| A. | 等物质的量的三种金属分别与足量的硫酸反应,金属钠放出H2最多 | |
| B. | 未经打磨的铝箔和经过打磨的铝箔,分别在酒精灯上加热至融化,前者融化不滴落,后者融化后滴落 | |
| C. | 铁表面的氧化膜是疏松的,不能保护内层的铁 | |
| D. | 钠跟氯化铜溶液反应,有红色沉淀生成 |
分析 A.等物质的量的金属失电子越多,置换生成的氢气越多;
B.经过打磨的铝箔在酒精灯上加热迅速生成氧化铝;
C.铁被腐蚀生成的氧化铁为为疏松的氧化膜;
D.钠与盐溶液的反应是先与水反应.
解答 解:A.等物质的量的金属失电子越多,置换生成的氢气越多,等物质的量的三种金属分别与足量的硫酸反应,金属铝放出H2最多,故A错误;
B.经过打磨的铝箔在酒精灯上加热迅速生成氧化铝,加热时,氧化膜不熔化,所以熔化的铝不能滴落,故B错误;
C.铁被腐蚀生成的氧化铁为为疏松的氧化膜,氧化铁能从铁的表面剥落下来,不能保护内部金属,故C正确;
D.钠跟氯化铜溶液反应,是先与水反应生成氢氧化钠,氢氧化钠再与氯化铜反应生成氢氧化铜沉淀,即有蓝色沉淀生成,故D错误.
故选C.
点评 本题考查了金属及其化合物的性质,侧重于学生的分析能力的考查,注意把握常见金属的性质,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
3.常温下能用铁制容器盛放的是( )
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 硫酸铜 | D. | 稀硫酸 |
20.已知33As、35Br位于同一周期.下列关系正确的是( )
| A. | 原子半径:Br>Cl>P | B. | 热稳定性:AsH3>PH3 | ||
| C. | 碱性:CsOH>Ca(OH)2 | D. | 酸性:H3AsO4>H3PO4 |
7.配制250mL 0.1mol•L-1的盐酸时,对于下列实验操作的叙述正确的是( )
| A. | 用量筒量取所需的浓盐酸时俯视刻度线,则溶液的浓度偏低 | |
| B. | 定容时仰视刻度线,则溶液的浓度偏高 | |
| C. | 需选用250mL容量瓶,洗涤后残留少量蒸馏水,必须烘干后使用 | |
| D. | 定容后倒转容量瓶几次,发现液面最低点低于刻度线,需要再补几滴蒸馏水 |
17.雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥.其中跟下列反应无关的是(反应中的条件未注明,也未配平)( )
| A. | N2+H2→NH3 | B. | N2+O2→NO | C. | NO+O2→NO2 | D. | NO2+H2O→HNO3+NO |
2.写出下列除杂的离子方程式,括号内的物质为杂质.
| 物质(杂质) | 离子方程式 |
| FeCl2 (FeCl3) | (1)2Fe3++Fe=3Fe2+ |
| CO2 (HC1) | (2)H++HCO3-=H2O+CO2↑ |
| NaHC03 溶液(Na2C03) | (3)CO32-+CO2+H2O=2HCO3- |
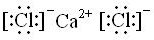 ,属于离子化合物.
,属于离子化合物.



 以香豆素3甲酸乙酯(
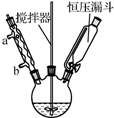
以香豆素3甲酸乙酯(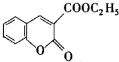 )为原料合成香豆素3甲酸(
)为原料合成香豆素3甲酸(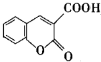 )的装置如图所示,实验步骤如下:
)的装置如图所示,实验步骤如下: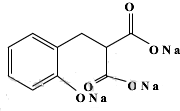 +C2H5OH+H2O.
+C2H5OH+H2O.