题目内容
1. 以香豆素3甲酸乙酯(
以香豆素3甲酸乙酯(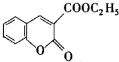 )为原料合成香豆素3甲酸(
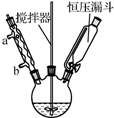
)为原料合成香豆素3甲酸(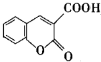 )的装置如图所示,实验步骤如下:
)的装置如图所示,实验步骤如下:步骤1:在100mL三颈烧瓶中,加入25mL 95%的乙醇溶液、50mL 14%的NaOH溶液和5.45g香豆素3甲酸乙酯,加热回流15分钟.
步骤2:边搅拌边将反应混合物倒入70mL盐酸中,析出晶体.
步骤3:抽滤得到粗产品.
步骤4:加入50%乙醇重结晶,得到白色晶体3.80g.
(1)步骤1中发生反应的化学方程式为
 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +C2H5OH+H2O.
+C2H5OH+H2O.(2)反应装置中冷凝水从b口进入(填“a”或“b”).
(3)步骤2中加入盐酸的目的是水解形成的钠盐转化为香豆素3甲酸.
(4)步骤3抽滤完毕或中途停止抽滤时,应先断开漏斗与安全瓶的连接,然后关闭水龙头.
(5)本次实验中香豆素3甲酸的产率为80.0%.
分析 (1)香豆素3甲酸乙酯(OCOOC2H5O)与氢氧化反应生成OCOONaO与C2H5OH;
(2)用从b口通入冷凝水,充分冷却蒸汽;
(3)将反应混合物倒入70mL盐酸中,析出晶体,将钠盐转化为香豆素3甲酸;
(4)步骤3抽滤完毕或中途停止抽滤时,断开漏斗与安全瓶的连接 关闭水龙头;
(5)根据香豆素3甲酸乙酯计算香豆素3甲酸的理论产量,进而计算器产率.
解答 解:(1)步骤1中发生反应的化学方程式为: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +C2H5OH+H2O,
+C2H5OH+H2O,
故答案为: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +C2H5OH+H2O;
+C2H5OH+H2O;
(2)用从b口通入冷凝水,冷凝管中充满冷凝水充分冷却蒸汽,
故答案为:b;
(3)将反应混合物倒入70mL盐酸中,析出晶体,将水解形成的钠盐转化为香豆素3甲酸,
故答案为:水解形成的钠盐转化为香豆素3甲酸;
(4)步骤3抽滤完毕或中途停止抽滤时,断开漏斗与安全瓶的连接,关闭水龙头,
故答案为:断开漏斗与安全瓶的连接;关闭水龙头;
(5)香豆素3甲酸乙酯的分子式为C12H10O4,香豆素3甲酸的分子式为C10H6O4,理论上生成香豆素3甲酸的质量为5.45g×$\frac{190}{218}$=4.75g,则产率为$\frac{3.80g}{4.75g}$×1005=80.0%,
故答案为:80.0%.
点评 本题考查有机物制备实验,涉及实验基本操作、对操作的分析评价、有机反应方程式书写、产率计算等,注意掌握官能团的性质与转化.

练习册系列答案
相关题目
12.钠、铝、铁是中学化学常见的三种金属.下列说法中正确的是( )
| A. | 等物质的量的三种金属分别与足量的硫酸反应,金属钠放出H2最多 | |
| B. | 未经打磨的铝箔和经过打磨的铝箔,分别在酒精灯上加热至融化,前者融化不滴落,后者融化后滴落 | |
| C. | 铁表面的氧化膜是疏松的,不能保护内层的铁 | |
| D. | 钠跟氯化铜溶液反应,有红色沉淀生成 |
16.下列反应中的氨与反应4NH3+5O2=4NO+6H2O中的氨作用相同的是( )
| A. | 2Na+2NH3═2NaNH2+H2↑ | B. | 2NH3+3CuO═3Cu+N2+3H2O | ||
| C. | 4NH3+6NO═5N2+6H2O | D. | HCl+NH3═NH4Cl |
6.CH2=C(CH3)-CH=CH3,叫做异戊二烯.已知维生素A的结构简式可写为 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )| A. | 能被氧化为酮 | |
| B. | 维生素A是一种易溶于水的不饱和醇 | |
| C. | 维生素A的分子式为C20H32O | |
| D. | 维生素A分子中有异戊二烯的碳链结构 |
13.A、B两原子,A原子L层比B原子M层少3个电子,B原子L层电子数恰为A原子L层电子数的2倍,则A、B分别是( )
| A. | 硅和钠 | B. | 硼和氮 | C. | 碳和氯 | D. | 碳和铝 |
