题目内容
14.NA为阿伏加德罗常数,则下列说法正确的是( )| A. | 已知C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)△H=-1300KJ/mol 当有5NA个电子转移时能放出650KJ的热量 | |
| B. | 有28g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 有反应H2(g)+I2(g)?2HI(g)△H=-QHJ/mol在298K 101KPa下向一密闭容器中充入NA个H2和NA个I2,充分反应共放出热量为QKJ | |
| D. | 在78g苯中含3NA个碳碳双键 |
分析 A、在C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)反应中,当1mol乙炔反应时,转移10mol电子,放出1300KJ的热量;
B、乙烯和丙烯的最简式均为CH2;
C、H2和I2的反应为可逆反应;
D、苯不是单双键交替的结构.
解答 解:A、在C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)反应中,当1mol乙炔反应时,转移10mol电子,放出1300KJ的热量,故当有5NA个电子转移时,放出650KJ的热量,故A正确;
B、乙烯和丙烯的最简式均为CH2,故28g混合物中含有的CH2的物质的量为n=$\frac{28g}{14g/mol}$=2mol,故含6mol原子即6NA个,故B错误;
C、H2和I2的反应为可逆反应,不能进行彻底,故NA个H2和NA个I2不能完全反应,则放出热量小于QKJ,故C错误;
D、苯不是单双键交替的结构,故苯中无碳碳双键,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
5.设NA代表阿伏伽德罗常数的数值,则下列说法正确的是( )
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| C. | 50ml 18.4mol/L浓硫酸与足量铜微热,生成气体0.46NA | |
| D. | 25℃时,7g C2H4和C3H6的混合气体中,含有NA个C-H键 |
2.纯水在20℃和80℃时的pH( )
| A. | 前者大 | B. | 后者大 | C. | 相等 | D. | 无法确定 |
9.关于Na2CO3和NaHCO3性质的说法不正确的是( )
| A. | 在水中的溶解性:NaHCO3<Na2CO3 | |
| B. | 相同条件下,与等浓度盐酸反应生成CO2的速率:NaHCO3<Na2CO3 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出CO2更多 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
6.中国-094核潜艇上的核反应堆内使用了液体钠铝合金(单质钠和单质铝熔合而成,可看作二者的混合物)做载热介质,将一定质量的合金进行实验,有关说法不正确的是( )
| A. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入足量水中,若放出的H2越多,则铝的质量分数越大 | |
| D. | 铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越大 |
3.若某体系所吸收的热量全部用于体系的内能增加,则所需的条件是( )
①封闭体系;②不做体积功其他功;③恒压;④恒温.
①封闭体系;②不做体积功其他功;③恒压;④恒温.
| A. | ②和④ | B. | ①和③ | C. | ①和② | D. | ①和④ |
8.将10mL0.5mol/L NaOH 溶液,加水稀释到100mL,稀释后溶液中NaOH 的物质的量浓度为( )
| A. | 0.05 mol/L | B. | 0.01 mol/L | C. | 0.02 mol/L | D. | 0.03 mol/L |
 ;组成单质丁的元素的原子结构简图为
;组成单质丁的元素的原子结构简图为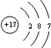 .
.